题目内容
20.氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )| A. | 1 mol•L-1 HCN溶液的pH约为3 | |
| B. | HCN易溶于水 | |
| C. | 10 mL 1 mol•L-1 HCN溶液恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 在相同条件下,HCN溶液的导电性比强酸溶液的弱 |
分析 弱电解质定义:只能部分电离的电解质为弱电解质,电解质的强弱与水溶性无关,一般测定溶液的pH或测定相同条件下与强酸的导电性比较来判断,据此解答.
解答 解:A.氢氰酸为一元酸,1mol/L氢氰酸溶液的pH=0时该酸为强酸,但pH约为3,说明电离生成的氢离子约为10-3mol/L<1mol/L,电离不完全,故A正确;
B.电解质强弱与水溶性无关,故B错误;
C.10 mL 1 mol•L-1 HCN溶液恰好与10 mL 1 mol•L-1NaOH溶液完全反应,只能说明HCN为一元酸,不能说明其电离的程度,故C错误;
D.HCl为一元强酸,在相同条件下,HCN溶液的导电性比盐酸溶液弱,则说明HCN电离不完全,故D正确;
故选:AD.
点评 本题考查弱电解质的判断方法,明确弱电解质在水中电离不完全是解答本题的关键,注意在平时的学习中归纳判断弱电解质的方法,题目难度不大.

练习册系列答案
相关题目
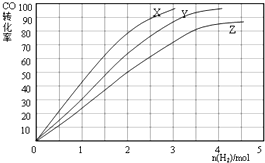
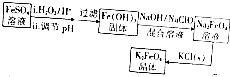
8.下列四个图象的有关描述错误的是( )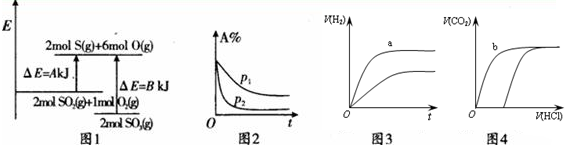
注:△E:表示能量,p表示压强;t表示时间,V表示体积,%表示B的体积百分含量.

注:△E:表示能量,p表示压强;t表示时间,V表示体积,%表示B的体积百分含量.
| A. | 图1表示化学反应2S02(g)+O2(g)?2S03(g)的能量变化,该反应的△H=A一BkJ/mol | |
| B. | 图2表示其他条件不变时,反应2A(g)+B(g)?c(g)+D(g)在不同压强下随时间的变化 | |
| C. | 图3表示体积和浓度均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | 图4表示100 ml O.1 mol•L-Na2C03和NaHC03两种溶液中,分别逐滴滴加0.1 mol•L-1HCl,产生CO2 的体积随盐酸体积的变化,则b表示NaHCO3溶液 |
12.下列溶液中氯离子浓度最大的是( )
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 50 mL 0.5 mol•L-1AlCl3溶液 | ||
| C. | 200 mL 1 mol•L-1NaCl溶液 | D. | 200 mL 2 mol•L-1KClO3溶液 |
9.25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和11.下列说法正确的是( )
| A. | 在0.1 mol•L-1BA溶液中c(A-)+c(H+)=c(BOH)+c(OH-) | |
| B. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1则溶液的pH=9 | |
| C. | 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) | |
| D. | 若将上述两溶液按体积比1:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |

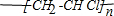
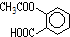 ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.