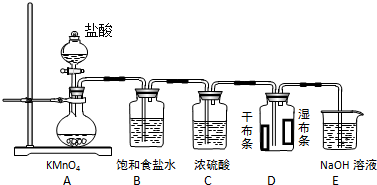
题目内容
13.测定硫酸铜晶体(CuSO4•xH2O)中x值的实验过程如下.完成下列填空: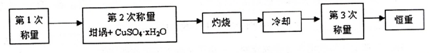
(1)设待测硫酸铜晶体的化学式为CuSO4•xH2O,则该硫酸铜晶体受热失去全部结晶水的化学方程式为CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O.

a.研钵 b.镊子 c.坩埚 d.三角架
(2)下列是实验中用到的几种仪器,仪器与对应名称正确的是ac.(填序号)
(3)“冷却”操作应在干燥器(填仪器名称)中进行,“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是酒精喷灯温度太高,容易使CuSO4受热分解.
(4)恒重操作的目的是确保硫酸铜晶体失水完全.
(5)测定硫酸铜晶体结晶水含量时,若实验结果偏低,原因可能是d.(填序号)
a.坩埚未完全干燥b.加热过程中晶体有少量溅失
c.坩埚上沾有受热不分解的杂质d.加热后未放入干燥器中冷却
(6)下面是某学生实验的一次数据,请完成计算
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 11.721g | 22.692g | 18.631g | a |
(2)若加热后坩埚与固体总质量为18.631g,实测值x=5.22(保留两位小数)
(3)若理论值x=5,则该实验的相对误差是4.4%.
分析 (1)硫酸铜晶体受热失去全部结晶水生成无水硫酸铜,根据元素守恒书写化学方程式;
(2)根据仪器的图可知其名称;
(3)为防止无水硫铜在冷却过程 中吸收空气中的水份,影响实验结果,冷却应在干燥器中,晶体加热时温度过高,硫酸铜会分解;
(4)恒重操作的目的是确保硫酸铜晶体失水完全;
(5)a.坩埚未完全干燥,会使测得的结晶水的质量偏大;
b.加热过程中晶体有少量溅失,会使测得的结晶水的质量偏大;
c.坩埚上沾有受热不分解的杂质,对测得的结晶水的质量没有影响;
d.加热后未放入干燥器中冷却,吸收了空气中的水份,会使测得的结晶水的质量偏小;
(6)(1)恒重操作时,两次固体质量差小于0.1g,据此判断;
(2)若加热后坩埚与固体总质量为18.631g,则结晶水的质量为4.061g,硫酸铜晶体的质量为10.971g,根据结晶水和无水硫酸铜的关系可确定x的值;
(3)根据相对误差=$\frac{绝对误差}{理论值}$×100%计算.
解答 解:(1)硫酸铜晶体受热失去全部结晶水生成无水硫酸铜,反应的化学方程式为CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O,
故答案为:CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O;
(2)根据仪器的图可知,a为研钵,b为坩埚钳,c为坩埚,d为泥三角,仪器与对应名称正确的是ac,
故答案为:ac;
(3)为防止无水硫铜在冷却过程 中吸收空气中的水份,影响实验结果,冷却应在干燥器中,酒精喷灯对晶体加热时温度过高,硫酸铜会分解,
故答案为:干燥器;酒精喷灯温度太高,容易使CuSO4受热分解;
(4)恒重操作的目的是确保硫酸铜晶体失水完全,
故答案为:确保硫酸铜晶体失水完全;
(5)a.坩埚未完全干燥,会使测得的结晶水的质量偏大,会使实验结果偏高;
b.加热过程中晶体有少量溅失,会使测得的结晶水的质量偏大,会使实验结果偏高;
c.坩埚上沾有受热不分解的杂质,对测得的结晶水的质量没有影响;
d.加热后未放入干燥器中冷却,吸收了空气中的水份,会使测得的结晶水的质量偏小,会使实验结果偏低,
故选d;
(6)(1)恒重操作时,两次固体质量差小于0.1g,即a的值在18.630-18.632之间,
故答案为:18.630-18.632;
(2)若加热后坩埚与固体总质量为18.631g,则结晶水的质量为4.071g,硫酸铜晶体的质量为10.971g,根据$\frac{18x}{160+18x}=\frac{4.061}{10.971}$可得x=5.22,
故答案为:5.22;
(3)若理论值x=5,则该实验的相对误差是$\frac{5.22-5}{5}$×100%=4.4%,
故答案为:4.4%.
点评 本题考查了硫酸铜晶体中结晶水含量的测定,题目难度不大,注意掌握测定硫酸铜晶体结晶水含量的方法,明确实验过程中恒重称量的意义及硫酸铜晶体中结晶水的计算方法.

| A. | CaO+H2O═Ca(OH)2 | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 2NaOH+CO2═Na2CO3+H2O | D. | Fe+2HCl═H2↑+FeCl2 |
(1)分别向浓度均为0.1mol/LNa2CO3及NaHCO3溶液中滴加几滴酚酞试剂:
①Na2CO3溶液由无色变为红色,其原因是CO32-+H2O?HCO3-+OH-.
②NaHCO3溶液也由无色变为红色,其原因是HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,水解程度大于电离程度.
③比较两份溶液的颜色,红色较浅的是NaHCO3(填化学式).
(2)研究NaHCO3与CaCl2的反应.
| 实验序号 | 实验操作 | 实验现象 |
| 实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
| 实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
②实验2中形成的分散系属于胶体.
③用离子方程式表示实验2中发生的反应Ca2++2HCO3-=CaCO3↓+CO2+H2O.
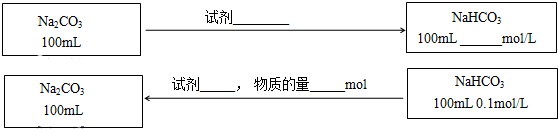
(3)在不引入其他杂质的前提下,实现Na2CO3与NaHCO3之间的转化,请在图中标出所用的试剂、用量或物质的浓度(反应前后溶液体积的变化可忽略).
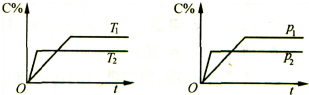
| A. | Tl>T2,△H<O | B. | Tl<T2,△H<O | C. | Pl>P2,a+b>c | D. | Pl<P2,a+b>c |
| A. | 2Fe+4H2O═Fe2O3+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | Ca(OH)2+SO2═CaSO3+H2O | D. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O |