题目内容
4.下列各溶液中,微粒的物质的量浓度关系正确的是( )| A. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
分析 A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合得到醋酸、氯化钠和少量HCl;
B.0.1 mol/L pH为4的NaHB溶液中HB-离子电离大于其水解;
C.在NaHA溶液中一定有电荷守恒,阴阳离子所带电荷总数相同;
D.氢离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,电离出铵根离子浓度越多的其物质的量浓度越小,据此判断.
解答 解:A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合得到醋酸、氯化钠和少量HCl,溶液中离子浓度大小为c(Cl-)>c(Na+)>c(H+)>c(OH-),故A错误;
B.0.1 mol/L pH为4的NaHB溶液中HB-离子电离大于其水解,微粒浓度大小为:c(HB-)>c(B2-)>c(H2B),故B错误;
C.在NaHA溶液中一定存在电荷守恒:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),故C错误;
D.铵根离子水解,(NH4)2SO4中含有2个铵根离子,所以铵根离子浓度最大,(NH4)2 CO3中含有2个铵根离子,碳酸根离子和铵根离子相互促进水解,NH4Cl是强酸弱碱盐,铵根离子能水解但较弱,所以当它们物质的量浓度相同时,c(NH4+)大小顺序为c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl),所以如果c(NH4+)相同,电离出铵根离子浓度越多的其物质的量浓度越小,所以当c(NH4+)相同时,物质的量浓度由大到小的顺序为c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl),故D正确;
故选D.
点评 本题考查了盐类水解、电解质溶液中电荷守恒、溶液酸碱性分析判断,注意盐类水解和电离程度的理解,掌握基础是解题关键,题目难度中等.

 某同学用如图实验装置验证通过改变浓度来实现反应,2Fe3++2I-═2Fe2++I2中Fe3+与Fe2+的相互转化.K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反.下列有关说法不正确的是( )
某同学用如图实验装置验证通过改变浓度来实现反应,2Fe3++2I-═2Fe2++I2中Fe3+与Fe2+的相互转化.K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反.下列有关说法不正确的是( )| A. | 指针第一次偏转时,b极反应式为Fe3++e-═Fe2+ | |
| B. | 加入AgNO3后,a为正极 | |
| C. | 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA | |
| D. | 第二次指针偏转的原因是:I-浓度减小,反应逆向进行 |
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到NaOH浓溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干,趁热过滤 |
| C | 除去HBr中混有的Br2 | 将混合气通入盛有CCl4的洗气瓶 |
| D | 证明Cu(OH)2的溶度积比Mg(OH)2的小 | 将1mL0.1mol•L-1MgSO4溶液逐滴滴入4mL0.1mol•L-1NaOH溶液,再滴加1mL0.1mol•LCuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 10s内,X的平均反应速率为0.025 mol•L-1•s-1 | |
| B. | 第10s时,Y的反应速率为0.075 mol•L-1•s-1 | |
| C. | 第10s时,X为 1.5 mol,Y的浓度为0.25 mol•L-1 | |
| D. | 10s内,X和Y反应放出的热量为a kJ |
| A. | K+、Na+、Cl-、SO32- | B. | K+、Na+、NO3-、SO42- | ||
| C. | K+、NH4+、NO3-、SO42- | D. | K+、Mg2+、NO3-、Cl- |
| A. | 食盐既可以做调味剂,又可以做防腐剂 | |
| B. | 纯碱既可以做清洗品,又可以做发酵粉 | |
| C. | 漂白粉既可以做消毒剂,又可以做漂白剂 | |
| D. | 酒精既可以做饮料,又可以做燃料 |
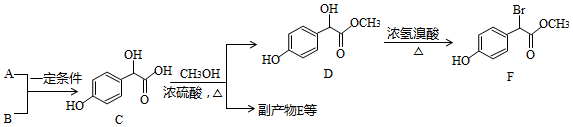
 .
.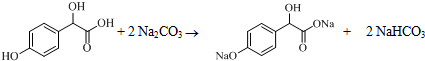 .
. .
.