题目内容
3.氯气是重要的化工原料.(1)工业上常用电解饱和食盐水法生产氯气,写出发生反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)工业上常用石灰乳和氯气反应制取漂白粉,化学反应方程式是2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.部分流程如图所示,其主要设备是氯化塔,塔从上到下分四层.将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入,这样加科的目的是增大反应物间的接触面积,使反应充分进行;°

(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是6OH-+3Cl2=5Cl-+ClO3-+3H2O,其原因可能是反应放热使温度升高所致,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生.
分析 (1)工业用电解饱和食盐水的方法制备氯气,反应方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)用熟石灰和氯气反应制取漂白粉,反应生成氯化钙、次氯酸钙、水;含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入时接触面积增大;
(3)较浓的KOH溶液直接吸收氯气,生成KCl、KClO3、水,该反应与温度有关.
解答 解:(1)工业用电解饱和食盐水的方法制备氯气,电解饱和食盐水反应生成NaOH、H2、Cl2,该反应为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:电解饱和食盐水;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)氯气通入石灰乳[Ca(OH)2]制取漂白粉,反应生成CaCl2、Ca(ClO)2、H2O,该反应为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入时接触面积增大,使反应充分进行,
故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;增大反应物间的接触面积,使反应充分进行;
(3)较浓的KOH溶液直接吸收氯气,生成KCl、KClO3、水,离子反应为6OH-+3Cl2=5Cl-+ClO3-+3H2O,发生该反应是因反应放热使温度升高所致,故答案为:6OH-+3Cl2=5Cl-+ClO3-+3H2O;反应放热使温度升高所致.
点评 本题考查氯气的性质及化学反应方程式的书写,为高频考点,明确反应物与生成物即可解答,题目较简单,注意相关基础知识的积累.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案| A. | 质子数为16、中子数为17的硫原子:$\stackrel{17}{16}S$ | |
| B. | 硫离子(S2-)的结构示意图: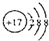 | |
| C. | 二硫化碳分子的结构式:S=C=S | |
| D. | 硫化氢分子的电子式: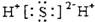 |
| A. | 蓄电池放电时,每消耗0.1molPbO2,则共生成0.1molPbSO4 | |
| B. | 电解硫酸钠溶液时的阳极反应式为4OH--4e=2H2O+O2↑ | |
| C. | 电解一段时间后若硫酸钠溶液中没有晶体析出则c(Na2SO4)不变 | |
| D. | 蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变大 |
| A. | 4(mol/L) 2 | B. | 16(mol/L) 2 | C. | 20(mol/L) 2 | D. | 25(mol/L) 2 |
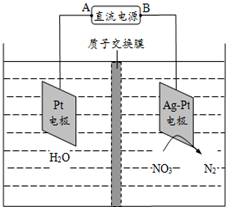
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| C. | 该电解池的总反应方程式为:2H2O+4NO3-$\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
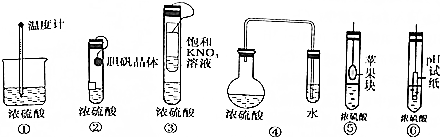
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | H2O→H2 | B. | FeCl3→FeCl2 | C. | C→CO2 | D. | CaO→Ca(OH)2 |
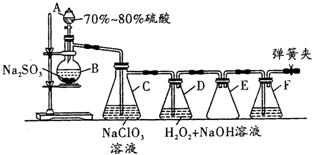 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.