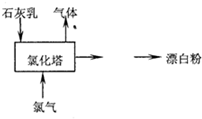
题目内容
14.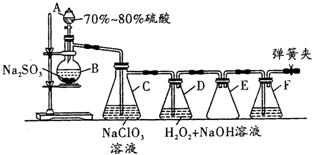 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.装置D中发生反应:2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2
(1)ClO2、O3常被用作消毒剂,等物质的量的ClO2(还原产物为Cl-)、O3(1mol O3转化为1mol O2和1mol H2O),二者消毒效率之比为5:2.
(2)组装好仪器后,检查该装置的气密性的方法是关闭两个弹簧夹,打开A中活塞,向B中注入水,水滴的速度逐渐变慢,最后停止滴入,说明气密性良好.
(3)F中盛有的液体是氢氧化钠溶液;装置E的作用是安全瓶;装置A盛装的是70%~80%的硫酸,不能用较浓的硫酸或较稀的硫酸,原因是太浓的硫酸不利于电离出氢离子,太稀的硫酸会溶解更多二氧化硫,不利于二氧化硫的逸出.
(4)实验开始时,C中发生反应的化学方程式为2NaClO3+SO2═2ClO2+Na2SO4.
(5)通过检测发现制备的NaClO2中含有NaOH、Na2SO3或NaOH、Na2SO4等杂质,利用所给试剂设计实验,检测产品中存在Na2SO3,简要说明实验操作,现象和结论:取适量D中的溶液于试管中,加入Ba(OH)2溶液产生白色沉淀,过滤,向白色沉淀中加入稀盐酸,产生气体证明含有亚硫酸钠
(供选择的试剂:Ba(OH)2溶液、品红溶液、H2O2溶液、AgNO3溶液、稀盐酸)
(6)ClO2-的含量可用碘量法测定,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,写出反应的离子方程式ClO2-+4H++4I-=Cl-+2I2+2H2O.
分析 (1)依据等物质的量的ClO2(还原产物为Cl-)、O3(1mol O3转化为1mol O2和1mol H2O),转移电子数目计算;
(2)检验装置气密性,可以形成封闭体系,打开A中活塞,向B中注入水,看水滴的速度;
(3)二氧化硫有毒,需要进行尾气处理,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收;
装置D中发生反应:2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2为气体体积减小的反应,D中压强容易发生倒吸,据此判断E作用;实验室制备二氧化硫不能用浓硫酸,太浓的硫酸不利于电离出氢离子,也不能用浓度太低的硫酸,因为二氧化硫易溶于水,太稀的硫酸会溶解更多二氧化硫,不利于二氧化硫的逸出;
(4)氯酸钠与二氧化硫发生氧化还原反应生成二氧化氯和硫酸钠;
(5)依据亚硫酸根离子能够与钡离子反应生成亚硫酸钡沉淀,亚硫酸根离子能够与盐酸反应生成二氧化硫气体解答;
(6)根据题意ClO2-与I-反应在酸性条件进行,产物为I2和Cl-,根据质量守恒可写出离子方程式;
解答 解:(1)ClO2、O3常被用作消毒剂,等物质的量的ClO2(还原产物为Cl-)、O3(1mol O3转化为1mol O2和1mol H2O),都取1molClO2、O3,则1molClO2转化1molCl-,得到5mol电子;1mol O3转化为1mol O2和1mol H2O)得到2mol电子,则二者消毒效率之比为:5:2;
故答案为:5:2;
(2)组装好仪器后,检查该装置的气密性的方法是:关闭两个弹簧夹,打开A中活塞,向B中注入水,水滴的速度逐渐变慢,最后停止滴入,说明气密性良好;
故答案为:关闭两个弹簧夹,打开A中活塞,向B中注入水,水滴的速度逐渐变慢,最后停止滴入,说明气密性良好;
(3)二氧化硫有毒,需要进行尾气处理,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收,所以F中盛有氢氧化钠溶液;
装置D中发生反应:2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2为气体体积减小的反应,D中压强容易发生倒吸,所以装置E可以防止倒吸的发生,做安全瓶;
装置A盛装的是70%~80%的硫酸,不能用较浓的硫酸或较稀的硫酸,原因是太浓的硫酸不利于电离出氢离子,太稀的硫酸会溶解更多二氧化硫,不利于二氧化硫的逸出;
故答案为:氢氧化钠溶液;安全瓶;太浓的硫酸不利于电离出氢离子,太稀的硫酸会溶解更多二氧化硫,不利于二氧化硫的逸出;
(4)氯酸钠与二氧化硫发生氧化还原反应生成二氧化氯和硫酸钠,化学方程式:2NaClO3+SO2═2ClO2+Na2SO4;
故答案为:2NaClO3+SO2═2ClO2+Na2SO4;
(5)亚硫酸根离子能够与钡离子反应生成亚硫酸钡沉淀,亚硫酸根离子能够与盐酸反应生成二氧化硫气体,所以检验方法:取适量D中的溶液于试管中,加入Ba(OH)2溶液产生白色沉淀,过滤,向白色沉淀中加入稀盐酸,产生气体证明含有亚硫酸钠;
故答案为:取适量D中的溶液于试管中,加入Ba(OH)2溶液产生白色沉淀,过滤,向白色沉淀中加入稀盐酸,产生气体证明含有亚硫酸钠;
(6)ClO2-与I-反应在酸性条件进行,产物为I2和Cl-,根据质量守恒可写出离子方程式为:ClO2-+4H++4I-=Cl-+2I2+2H2O,
故答案为:ClO2-+4H++4I-=Cl-+2I2+2H2O;
点评 本题考查了亚氯酸钠(NaClO2)的制备,明确二氧化硫的制备原理及氧化还原反应规律是解题关键,题目难度较大.

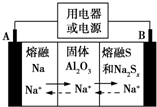 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 放电时,电极A为负极,Na+由B向A移动 | |
| B. | 放电时,负极反应式为2Na-xe-═2Na+ | |
| C. | 充电时,电极B的反应式为S2--2e-═xS | |
| D. | 充电时,电极B接电源的负极 |

| A. | 氧化反应与化合反应属于并列关系 | B. | 单质与化合物属于交叉关系 | ||
| C. | 化合物与氧化物属于包含关系 | D. | 纯净物与混合物属于包含关系 |
| A. | 二氧化硅是制造光电池的主要原料 | |
| B. | 硅是现代光学及光纤制品的基本原料 | |
| C. | 可用石英坩埚加热氢氧化钠固体 | |
| D. | 在电子工业中,硅是重要的半导体材料 |
| A. |  分离碘和酒精 | B. |  除去Cl2中的HCl | C. |  排水法收集NO | D. |  配置硫酸溶液 |
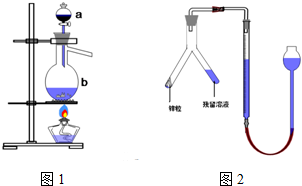
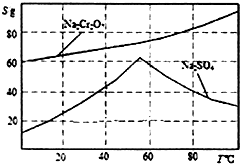 实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).
实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).