题目内容
15.电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO${\;}_{3}^{-}$的原理如图所示,下列说法不正确的是( )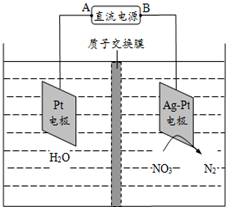
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| C. | 该电解池的总反应方程式为:2H2O+4NO3-$\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
分析 A.该装置中,硝酸根离子得电子发生还原反应,则Ag-Pt电极为阴极、Pt电极为阳极,A应为正极;
C.硝酸根离子被还原生成氮气,阳极生成氧气,据两极上的反应书写总反应式;
B.阴极上硝酸根离子得电子发生还原反应;
D.转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室.
解答 解:A.根据图知,电解槽右边部分N元素化合价由+5价变为0价,所以硝酸根离子发生还原反应,则Ag-Pt电极为阴极、Pt电极为阳极,所以A是正极,电极材料为PbO2,故A正确;
B.阴极上硝酸根离子得电子发生还原反应,氢离子通过质子交换膜进入右侧,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,故B正确;
C.硝酸根离子被还原生成氮气,阳极生成氧气,电解总方程式为2H2O+4NO3- $\frac{\underline{\;通电\;}}{\;}$2N2↑+5O2↑+4OH-,故C正确;
D.转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阴极的电极反应式为2NO3-+6H++10e-=N2↑+6OH-,转移2mol电子,阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故D错误.
故选D.
点评 本题考查了电解原理,为高频考点,根据N元素化合价变化确定阴阳极、正负极,难点是电极反应式的书写,易错选项是D,注意氢离子还进入阴极室,很多同学往往只考虑析出的气体而导致错误,为易错点.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
5.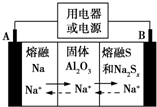 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 放电时,电极A为负极,Na+由B向A移动 | |
| B. | 放电时,负极反应式为2Na-xe-═2Na+ | |
| C. | 充电时,电极B的反应式为S2--2e-═xS | |
| D. | 充电时,电极B接电源的负极 |
10.某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.滴入几滴石蕊溶液后,用石墨作电极电解该混合溶液,根据电极产物,电解过程可明显分为三个阶段.下列叙述中,不正确的是( )
| A. | 电解过程中,Na+和SO42-的物质的量浓度保持不变 | |
| B. | 电解过程中,溶液颜色呈现红色→紫色→蓝色的变化 | |
| C. | 阴极产生的气体自始至终只有H2 | |
| D. | 第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl |
20.下列物质不能通过化合反应制得的是( )
| A. | FeCl2 | B. | Mg3N2 | C. | Fe(OH)3 | D. | BaSO4 |
7.下列各组括号内的试剂或方法不能除去杂质的是( )
| A. | Fe粉中混有Zn粉杂质(稀H2SO4) | B. | FeCl3溶液中混有FeCl2杂质(Cl2) | ||
| C. | NaCl固体中混有I2杂质(加热) | D. | SiO2中混有CaCO3杂质(盐酸) |
4.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘和酒精 | B. |  除去Cl2中的HCl | C. |  排水法收集NO | D. |  配置硫酸溶液 |
5.短周期元素X、Y、Z、W在元素周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,则下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | Y与氢元素形成的两种常见化合物均为分子晶体 | |
| D. | 四种元素的单质中,W单质的溶沸点最高 |
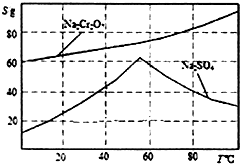 实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).
实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).