题目内容
11.下列有关硫元素及其化合物的表示正确的是( )| A. | 质子数为16、中子数为17的硫原子:$\stackrel{17}{16}S$ | |
| B. | 硫离子(S2-)的结构示意图: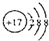 | |
| C. | 二硫化碳分子的结构式:S=C=S | |
| D. | 硫化氢分子的电子式: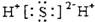 |
分析 A、在表示原子组成时,将质量数写在左上方,质子数写在左下方;
B、硫离子的核内有16个质子;
C、二硫化碳中为碳硫双键;
D、H2S为共价化合物.
解答 解:A、在表示原子组成时,将质量数写在左上方,质子数写在左下方,而质子数为16、中子数为17的硫原子的质量数为33,故表示为:1633S,故A错误;
B、硫离子的核内有16个质子,故硫离子的结构示意图为: ,故B错误;
,故B错误;
C、由于O和S为同一主族,故二硫化碳的结构式和二氧化碳的结构式非常相似,即结构中为碳硫双键,即为S=C=S,故C正确;
D、H2S为共价化合物,故其电子式为 ,故D错误.
,故D错误.
故选C.
点评 本题考查了电子式的书写判断、结构示意图的书写等,题目难度中等,注意掌握电子式的书写方法,明确原子的表示方法.

练习册系列答案
相关题目
2.化学概念在逻辑上存在如图所示关系. 对下列概念的说法正确的是( )

| A. | 氧化反应与化合反应属于并列关系 | B. | 单质与化合物属于交叉关系 | ||
| C. | 化合物与氧化物属于包含关系 | D. | 纯净物与混合物属于包含关系 |
16.下列实验操作正确的( )


| A. | 用装置甲组装铜锌原电池 | |
| B. | 用装置乙比较NaHCO3和Na2CO3的热稳定性 | |
| C. | 配制1L0.010mol•L-1的纯碱溶液时用精度为0.1g的天平秤取1.06gNa2CO3 | |
| D. | 中和滴定时,锥形瓶用蒸馏水清洗2次后不烘干就盛放一定量的待测稀盐酸 |
20.下列物质不能通过化合反应制得的是( )
| A. | FeCl2 | B. | Mg3N2 | C. | Fe(OH)3 | D. | BaSO4 |
1.如图所示的实验仪器名称是( )


| A. | 分液漏斗 | B. | 锥形瓶 | C. | 蒸馏烧瓶 | D. | 烧杯 |
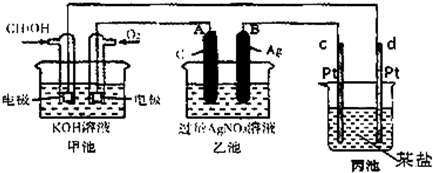
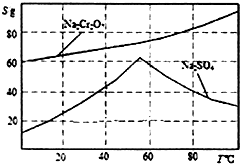 实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).
实验室模拟用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠(Na2Cr2O7•2H20).