题目内容
13.下列变化中,需加氧化剂才能实现的是( )| A. | H2O→H2 | B. | FeCl3→FeCl2 | C. | C→CO2 | D. | CaO→Ca(OH)2 |
分析 需加氧化剂才能实现,则选项中为还原剂的发生的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答 解:A.H2O→H2,H元素化合价降低,应该加入还原剂,故A错误;
B.FeCl3→FeCl2,Fe元素化合价降低,应该加入还原剂,故B错误;
C.C→CO2,元素化合价升高,加入氧化剂可实现,故C正确;
D.元素化合价不变,不是氧化还原反应,故D错误.
故选C.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应还原剂的考查,题目难度不大.

练习册系列答案
相关题目
4.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘和酒精 | B. |  除去Cl2中的HCl | C. |  排水法收集NO | D. |  配置硫酸溶液 |
1.如图所示的实验仪器名称是( )


| A. | 分液漏斗 | B. | 锥形瓶 | C. | 蒸馏烧瓶 | D. | 烧杯 |
8.下列物质中,只含共价键的化合物是( )
| A. | N2 | B. | CO2 | C. | MgO | D. | NaOH |
18.我国古代有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4═Cu+FeSO4.下列有关说法不正确的是( )
| A. | 该反应属于置换反应 | B. | Fe被氧化 | ||
| C. | CuSO4发生还原反应 | D. | 生成32g铜则转移2mol电子 |
5.短周期元素X、Y、Z、W在元素周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,则下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | Y与氢元素形成的两种常见化合物均为分子晶体 | |
| D. | 四种元素的单质中,W单质的溶沸点最高 |
2.随着原子序数的递增,八种短周期元素(x~h)原子半径的相对大小、最高正价或最低负价的变化如图所示.下列说法错误的是( )

| A. | y在元素周期表的位置是第二周期IVA族 | |
| B. | d元素常见离子的半径大于f元素常见离子的半径 | |
| C. | x,、z元素能组成一种四原子共价化合物,其电子式可以表示为 | |
| D. | e、f的最高价氧化物对应的水化物可以相互反应 |
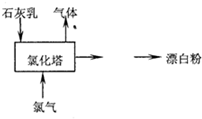
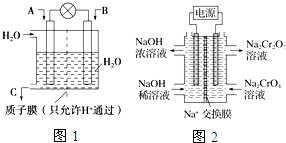 SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.
SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.