题目内容
10.回答下列问题:(1)如果实验室用98%的浓硫酸(密度为1.8g•cm-3 ) 配制2.4mol•L-1的稀硫酸250mL.计算所需浓硫酸的体积为33.3mL,在实验时应用50mL量筒
量取浓硫酸.
(2)配制操作可分解成如下几步,以下正确的操作顺序是DEACBHGF
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2cm
(3)由于错误操作,使得到的浓度数据比正确的偏大的是A.
A.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积,依据浓硫酸体积选择合适规格量筒;
(2)用浓溶液配制一定物质的浓度溶液一般步骤为:计算、量取、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,据此排序,注意容量瓶使用前需要检查是否漏水;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)98%的浓硫酸(密度为1.8g•cm-3 )物质的量浓度C=$\frac{1000×1.8×98%}{98}$=18mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得18mol/L×V=2.4mol•L-1×250mL,解得V=33.3mL,应选择50mL量筒;
故答案为:33.3;50mL量筒;
(2)用浓溶液配制一定物质的浓度溶液一般步骤为:计算、量取、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,则正确的操作步骤为:DEACBHGF;
故答案为:DEACBHGF;
(3)A.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度,导致溶液体积偏小,则溶液浓度偏高,故A选;
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B不选;
C.容量瓶用蒸馏水洗净,没有烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不选;
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故D不选;
E.把配好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用,导致溶液被稀释,溶液浓度偏低,故E不选;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶使用前需要检查是否漏水,注意误差分析的方法,题目难度不大.

①2BrO3-+Cl2═Br2+2ClO3-,
②ClO3-+5Cl-+6H+═3Cl2↑+3H2O,
③3Cl2+I2+6H2O=2HIO3+10HCl.
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | Cl2>BrO3->ClO3->HIO3 | B. | ClO3->BrO3->HIO3>Cl2 | ||
| C. | BrO3->Cl2>ClO3->HIO3 | D. | BrO3->ClO3->Cl2>HIO3 |
 )的一溴代物共有几种(不考虑立体异构)( )
)的一溴代物共有几种(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 第四周期第ⅢA族 | B. | 第四周期第ⅦA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅣB族 |
(1)为验证SO2具有还原性.将SO2气体通入溴水中,溴水褪色.写出反应的化学方程式SO2+Br2+2H2OH2SO4+2HBr.
(2)已知与SO2Na2O2的反应为进一步探究Na2O2与SO2的反应,用如图所示装置进行实验.
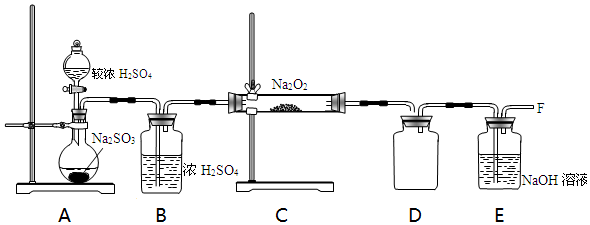
①写出A中反应的化学方程式H2SO4+Na2SO3 =Na2SO4+SO2↑+H2O.
②B装置的作用是干燥吸水.
③在F处检验到有O2生成,据此甲同学认为Na2O2与SO2发生了反应,反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2.
④乙同学认为Na2O2与SO2反应除生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下实验方案.
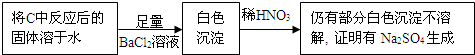
上述方案(“合理”或“不合理”)不合理,简要说明理由稀硝酸能将亚硫酸钡氧化为硫酸钡,如果反应后的固体中还残留Na2O2,它溶于水也能将亚硫酸根氧化成硫酸根.
⑤E装置中溶液呈碱性,为检验吸收液中其他阴离子,完成下列实验方案.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量吸收液于试管中滴加BaCl2溶液至过量 | 白色浑浊 | 吸收液中存在SO32-和SO42- |
| 取步骤I中白色沉淀于试管中,加入过量的稀盐酸 | 固体部分溶解,产生气泡 |
| A. | 甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{1}{2}$O2 (g)═CO2(g)+2H2 (g)△H1=-440.7kJ•mol-1 | |
| C. | 2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1 | |
| D. | 已知:S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
H2(g)+$\frac{1}{2}$O2(g)=H2O(g):△H=a kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l):△H=b kJ/mol
2H2O(g)=2H2(g)+O2(g):△H=c kJ/mol
关于它们的下列表述正确的是( )
| A. | a+b+c=0 | B. | c=2a | C. | a>b | D. | c=a+b |
| A. | 溶液中有Fe2+、Cu2+ | B. | 溶液中有Fe3+、Fe2+ | ||
| C. | 剩下的固体是Fe | D. | 溶液中不含Fe3+、Cu2+ |
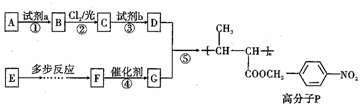
 ,试剂a是浓硫酸和浓硝酸.
,试剂a是浓硫酸和浓硝酸. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$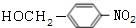 +NaCl.
+NaCl.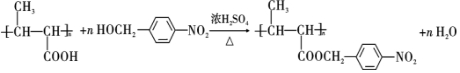 .
.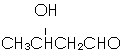 ,以E为起始原料.选用必要的无机试剂合成F,写出合成路线
,以E为起始原料.选用必要的无机试剂合成F,写出合成路线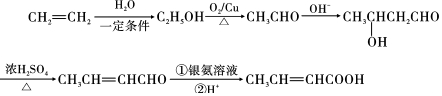 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).