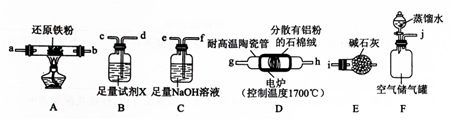
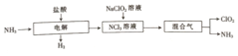
题目内容
10.下列叙述中正确的是( )| A. | 25℃,Cu(OH)2在水中的溶度积比其在 Cu(NO3)2溶液中的大 | |
| B. | 一定温度下,将 0.10mol•L-1的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2属于一元弱酸,则H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+OH-═H2PO2-+H2O | |
| D. | 常温下,NaHS溶液中:c(H+)+c(H2S)+c(Na+)=c(S2-)+c(OH-) |
分析 A.相同条件下,溶度积越大,溶解度越大,氢氧化铜为难溶物,硝酸铜为易溶物;
B.溶液中一水合氨存在电离平衡,加水稀释平衡状态下离子浓度减小,溶液中存在离子积常数,只随温度变化;
C.H3PO2 属于一元弱酸,则 H3PO2 与过量 NaOH 溶液反应按照1:1反应;
D.常温下,NaHS 溶液中存在电荷守恒和物料守恒,据此计算.
解答 解:A.25℃,Cu(NO3)2溶液中铜离子存在使沉淀溶解平衡逆向进行,Cu(OH)2在水中的溶解度小于硝酸铜,则该温度下氢氧化铜的溶度积比其在Cu(NO3)2溶液中的小,故A错误;
B.一定温度下,将 0.10 mol•L-1的氨水加水稀释,溶液中平衡状态下各离子浓度均减小,溶液中氢离子浓度增大,故B错误;
C..H3PO2 属于一元弱酸,则 H3PO2 与过量 NaOH 溶液反应按照1:1反应,反应的离子方程式为:H3PO2+OH-═H2PO2-+H2O,故C正确;
D.常温下,NaHS溶液中电荷守恒:c(H+)+c(Na+)=2c(S2-)+c(OH-)+c(HS-),c(Na+)=c(H2S)+c(HS-)+c(S2-),得到c(H+)+c(H2S)=c(S2-)+c(OH-),故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度大小、电荷守恒、物料守恒的计算分析、弱电解质电离影响因素,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 一定温度下,1molFeCl3水解生成NA个Fe(OH)3胶体颗粒 | |
| D. | 在标准状况下,2.24L苯中所含分子数约为NA |
18.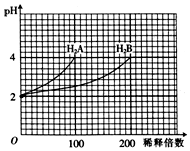 常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )
常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )
 常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )
常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )| A. | H2A的电离方程式为H2A?H++HA-、HA-?H++A2- | |
| B. | pH=4的NaHA水溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) | |
| C. | 含NaHA、NaHB的混合溶液中,各离子浓度关系为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) | |
| D. | NaHB水溶液中,各离子浓度的大小顺序为c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-) |
2.下列说法不正确的是( )

| A. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中不可能观察到有气泡产生 | |
| B. | 25℃时,将amol•L氨水与0.01mol•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(CI-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
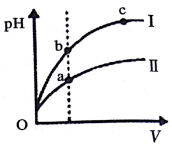
| C. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b | |
| D. | 向0.10mol•L-1NaHSO4溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略):c(Na+)>c(SO42-)>c(NH4+) |
19.下列离子方程式正确的是( )
| A. | 向FeCl3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| B. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 向稀硫酸中加入 Ba(OH)2 溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ |
20.下列有关说法不正确的是( )
| A. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| B. | 目前我国流通的硬币是由合金材料制造的 | |
| C. | 玻璃、水泥、陶瓷都为硅酸盐产品 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
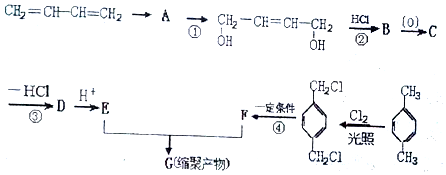
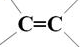 、-COOH.
、-COOH. .
.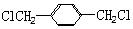 的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.
的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.