题目内容
15.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效、安全的消毒剂.实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如图: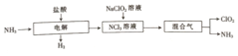
请回答下列问题:
(1)ClO2中Cl的化合价是+4.
(2)实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)NCl3与NaClO2(亚氯酸钠)反应的化学方程式为NCl3+3H2O+6NaClO2═6ClO2↑+3NaCl+3NaOH+NH3↑,该反应的氧化剂是NCl3,若产生11.2L(标准状况)NH3,则转移电子的总数为3NA.
(4)在用二氧化氯进行水处理时,除了杀菌消毒外,还能除去水中的Fe3+和Mn2+,写出用ClO2将Mn2+氧化为MnO2的离子方程式(ClO2反应后的产物为Cl-):5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+.
分析 由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3,在NCl3溶液中加入NaClO2发生氧化还原反应,可生成混合气体ClO2和NH3.
(1)根据化合物化合价代数和为0计算;
(2)NH4Cl和Ca(OH)2反应生成氨气、氯化钙;
(3)根据氧化剂的概念分析;根据NCl3+3H2O+6NaClO2═6ClO2↑+3NaCl+3NaOH+NH3↑可知,转移6mol电子生成氨气1mol,以此计算;
(4)ClO2氧化除去Mn2+生成MnO2,ClO2反应后的产物为ClO-2,以此书写离子方程式.
解答 解:(1)ClO2中氧元素-2价,化合物中化合价代数和为0,则氯元素+4价,故答案为:+4;
(2)实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)NCl3与NaClO2(亚氯酸钠)反应的化学方程式为NCl3+3H2O+6NaClO2═6ClO2↑+3NaCl+3NaOH+NH3↑,该反应中,NaClO2中氯元素由+3价升高到ClO2中的+4价,失电子,作还原剂,NCl3中的氮元素由+3价生成氨气中的-3价,得电子,作氧化剂,生成1mol氨气转移电子数为6mol,产生11.2L(标准状况)NH3,则转移电子的总数为$\frac{11.2L}{22.4L/mol}$×6×NA=3NA;
故答案为:NCl3;3;
(4)ClO2氧化除去Mn2+生成MnO2,ClO2反应后的产物为Cl-,该反应的离子方程式为5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+,
故答案为:5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+.
点评 本题考查物质的制备,涉及实验室制氨气、氧化还原反应的原理和有关计算,为高频考点,根据电子守恒及质量守恒定律得出化学反应方程式是解答本题的关键,题目难度中等.

| A. | 钠保存在煤油中 | |
| B. | 用棕色试剂瓶盛放新制的氯水 | |
| C. | 冷的浓硝酸不能用钢瓶保存 | |
| D. | 向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
| A. | 25℃,Cu(OH)2在水中的溶度积比其在 Cu(NO3)2溶液中的大 | |
| B. | 一定温度下,将 0.10mol•L-1的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2属于一元弱酸,则H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+OH-═H2PO2-+H2O | |
| D. | 常温下,NaHS溶液中:c(H+)+c(H2S)+c(Na+)=c(S2-)+c(OH-) |
| A. | 分子式为C5H12O的有机物,分子中含有2个甲基的同分异构体有4种 | |
| B. | 乙烷、苯、氯乙烯等三种有机化合物分子内所有原子均在同一平面上 | |
| C. | 由乙酸和乙醇制乙酸乙酯的反应及油脂的水解反应均属于取代反应 | |
| D. | 乙烯和苯都能使溴水褪色,且褪色的原理相同 |
| A. | (2m-1.6)g | B. | (m-0.8)g | C. | (m-1.6)g | D. | (2m-0.8)g |
| A. | 0.24 mol | B. | 0.22 mol | C. | 0.18 mol | D. | 0.16 mol |
 污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.