题目内容
5.氮化铝(AlN)是一种综合性能优良的陶瓷材料,能缓慢水解,不耐酸碱腐蚀,某小组探究在实验室制备AlN并测定产品纯度,设计实验如下,请回答:Ⅰ制备AlN
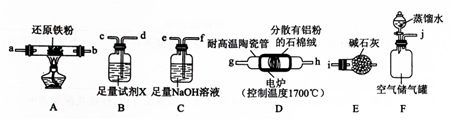
(1)实验时,以空气为原料制备AlN,按气流由左向右的方向,上述装置的正确连接顺序为j→fedcab(或ba)gh(或hg)→i(填仪器接口字母编号);
(2)上述装置中,需要检漏的仪器名称为分液漏斗;
(3)试剂X的作用为吸收空气中的水蒸气,避免其与还原铁粉反应干扰实验;
(4)装置D中发生反应的化学方程式为2Al+N2$\frac{\underline{\;高温\;}}{\;}$2AlN;
Ⅱ、测定产品纯度
(5)设计实验证明:装置D的产品中含有Al单质取D中少量产品于试管中,加入足量稀硫酸,有无色、无味的可燃性气体生成,则产品中含有铝单质;
(6)测定产品纯度:取装置D中产品4.37g,加入足量NaOH浓溶液,通入水蒸气,将生成的气体全部蒸出,用V1 mL c1 mol•L-1的盐酸吸收,以酚酞作指示剂,用c2 mol•L-1的NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗V2 mL NaOH标准溶液,则:
①达到滴定终点的现象为滴入最后一滴氢氧化钠标准液时,溶液的颜色从无色恰好变为浅红色,且半分钟不变色;
②产品中AlN的质量分数为$\frac{({V}_{1}mL×1{0}^{-3}L/mL×{C}_{1}mol/L-{V}_{2}mL×1{0}^{-3}L/mL×{C}_{2}mol/L)×41g/mol}{4.37g}$(列出计算式即可).
分析 (1)以空气为原料制备AlN,高温下,空气中的二氧化碳、氧气、和水蒸气会干扰实验,应先用氢氧化钠溶液除去二氧化碳,再用浓硫酸除去水蒸气,最后用还原铁粉除掉氧气,进而使氮气和铝高温反应,最后用碱石灰阻止空气进入装置,避免产品变质;
(2)带有活塞或旋塞的仪器要检查是否漏水,分液漏斗带玻璃活塞,需要检漏;
(3)由图中信息可知,装置C中氢氧化钠溶液的作用为吸收空气中的二氧化碳,装置A中还原铁粉的作用为除去氧气,故试剂B中试剂X为浓硫酸,其作用为干燥氮气;
(4)装置D中铝和纯净的氮气反应生成氮化铝;
(5)氮化铝和硫酸反应生成硫酸铝和硫酸铵,铝和硫酸反应生成硫酸铝和氢气,检验氢气的生成,即可证明有铝单质;
(6)①强碱滴定强酸时,酚酞:颜色由无色刚好变为浅红色,半分钟不变色为达到滴定终点;
②根据关系式AlN~NH3~HCl,NaOH~HCl列式计算.
解答 解:(1)以空气为原料制备AlN,铝和氧气生成氧化铝,高温下,铝和空气中的水蒸气能反应生成氢氧化铝和氢气,高温下,铝和空气中的二氧化碳能反应生成氧化铝和碳,二氧化碳、氧气、和水蒸气会干扰实验,应先用氢氧化钠溶液除去二氧化碳(j→f,e),再用浓硫酸除去水蒸气(e→d,c),最后用还原铁粉除掉氧气(c→ab)或(ba),进而使氮气和铝高温反应(gh(或hg)),AlN能缓慢水解,最后用碱石灰阻止空气进入装置(i),避免产品变质,
故答案为:fedcab(或ba)gh(或hg);
(2)由图中信息可知,该装置中的分液漏斗带玻璃活塞,洗净后需检漏,
故答案为:分液漏斗;
(3)高温下,空气中的二氧化碳、氧气、和水蒸气会干扰实验,高温下,铝和空气中的二氧化碳能反应生成氧化铝和碳,装置C中氢氧化钠溶液的作用为吸收空气中的二氧化碳,铝和氧气生成氧化铝,装置A中还原铁粉的作用为除去氧气,故试剂B中试剂X为浓硫酸,其作用为干燥氮气,避免水蒸气进入装置A中与还原铁粉反应,
故答案为:吸收空气中的水蒸气,避免其与还原铁粉反应干扰实验;
(4)装置D为氮化铝生成的装置,铝和纯净的氮气反应,反应方程式为:2Al+N2$\frac{\underline{\;高温\;}}{\;}$2AlN,
故答案为:2Al+N2$\frac{\underline{\;高温\;}}{\;}$2AlN;
(5)向含有氮化铝和铝的固体混合物中加入稀硫酸,氮化铝生成硫酸铝和硫酸铵,铝生成硫酸铝和氢气,检验氢气的生成,即可证明有铝单质,
故答案为:取D中少量产品于试管中,加入足量稀硫酸,有无色、无味的可燃性气体生成,则产品中含有铝单质;
(6)①强碱滴定强酸时,酚酞:颜色由无色刚好变为浅红色,达到滴定终点的现象为滴入最后一滴氢氧化钠标准液时,溶液的颜色从无色恰好变为浅红色,且半分钟不变色,
故答案为:滴入最后一滴氢氧化钠标准液时,溶液的颜色从无色恰好变为浅红色,且半分钟不变色;
②由关系式AlN~NH3~HCl,NaOH~HCl,可知n(AlN)=n(HCl)-n(NaOH),可计算产品中AlN的质量分数为:$\frac{({V}_{1}mL×1{0}^{-3}L/mL×{C}_{1}mol/L-{V}_{2}mL×1{0}^{-3}L/mL×{C}_{2}mol/L)×41g/mol}{4.37g}$,
故答案为:$\frac{({V}_{1}mL×1{0}^{-3}L/mL×{C}_{1}mol/L-{V}_{2}mL×1{0}^{-3}L/mL×{C}_{2}mol/L)×41g/mol}{4.37g}$.
点评 本题考查氮化铝的制备,侧重考查反应流程理解、装置的用途等,是对学生综合能力的考查,需要学生具备扎实的基础,关键在于能够掌握实验操作的原理和注意事项,注意高温下,空气中的二氧化碳、氧气、和水蒸气会干扰实验是该题的解答关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L已烷含有分子的数目为0.1NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA |
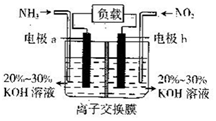 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示.下列说正确是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示.下列说正确是( )| A. | 电流从电极a经过负载后流向电极b | |
| B. | 为使电池持续放电,离子交换膜只允许阴离子通过 | |
| C. | 电极a的电极反应式为2NH3-6e-=N2+6H- | |
| D. | 室温下,当有4.48 L NO2被处理时,转移电子为0.8 mol |
| A. | HCl的电子式: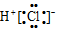 | B. | HClO的结构式:H-Cl-O | ||
| C. | NH4I的电子式: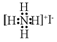 | D. | 甲烷分子球棍模型: |
| A. | 25℃,Cu(OH)2在水中的溶度积比其在 Cu(NO3)2溶液中的大 | |
| B. | 一定温度下,将 0.10mol•L-1的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2属于一元弱酸,则H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+OH-═H2PO2-+H2O | |
| D. | 常温下,NaHS溶液中:c(H+)+c(H2S)+c(Na+)=c(S2-)+c(OH-) |
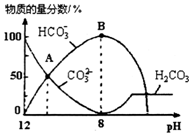 25℃时,H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )
25℃时,H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )| A. | A点所示溶液的pH<11 | |
| B. | B点所示溶液:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | A点→B点发生反应的离子方程式为CO32-+H+═HCO3- | |
| D. | 分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成 |
| A. | 酸性溶液中:Mg2+、K+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、A13+、NO3-、MnO4- | |
| C. | FeCl溶液中:Na+、NH4+、SCN-,SO42- | |
| D. | 与A1反应放出H2的溶液中:NH4+、Na+、NO3-、HCO3- |
| A. | NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | KNO3溶液(AgNO3):加过量KCl溶液,过滤 | |
| C. | Na2SO4溶液(Br2):加CCl4,萃取,分液 | |
| D. | NaHCO3溶液(Na2CO3):通入足量的CO2 |
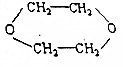 ,写出各步反应的化学方程式(一定要注明反应条件,有机物一定要写结构简式)(提示:电解食盐水可得NaOH,Cl2和H2)
,写出各步反应的化学方程式(一定要注明反应条件,有机物一定要写结构简式)(提示:电解食盐水可得NaOH,Cl2和H2)