题目内容
19.某铜矿主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.实验室以此铜矿石为原料制备CuSO4•5H2O及CaCO3,部分步骤如图: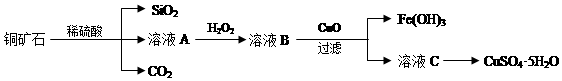
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有Fe2+、Fe3+(填离子符号);验证所含离子所用的试剂是在酸性高锰酸钾溶液、KSCN溶液.
(2)可用生成的CO2制取优质碳酸钙.制备时,先向氯化钙溶液中通入氨气,再通入CO2.
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气.某学习小组选取图1所给部分装置制取并收集纯净的氨气.
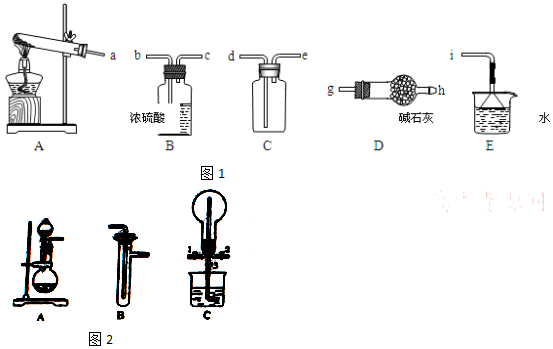
如果按气流方向连接各仪器接口,你认为正确的顺序为a→g、h→e、d→i.
其中与i相连漏斗的作用是防止倒吸.
②为探究氨气和氯气的反应(图2)
a.装置A、B,B装置内的药品依次是饱和食盐水、浓硫酸.
b.装置C可用于探究氯气与氨气(已知氯气和氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应.实验打开开关1、3,关闭2,先向烧瓶中通入氯气,然后关闭1、3,打开2,向烧瓶中缓缓通入一定量的另一种气体.实验一段时间后向烧瓶内出现浓厚的白烟并在容器内壁凝结.
(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:
a.将1.25g铜矿石制取的CuSO4•5H2O于锥形瓶中,加入适量水完全溶解;
b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;
c.过滤;
d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸.则铜矿石中Cu2(OH)2CO3质量分数为88.8%.
分析 Cu2(OH)2CO3以及Fe、Si的化合物与稀硫酸反应生成硫酸铜、硫酸亚铁、硫酸铁,二氧化硅与稀硫酸不反应,溶液A中加入双氧水具有强氧化性,能把亚铁离子氧化生成铁离子,所以在溶液A中加入H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,溶液B中加入氧化铜调节溶液PH使铁离子全部沉淀,过滤得到滤液,蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体,
(1)Cu2(OH)2CO3以及Fe、Si的化合物与稀硫酸反应生成硫酸铜、硫酸亚铁、硫酸铁,二氧化硅与稀硫酸不反应,所以溶液中A中除含有Cu2+外,还可能含有的金属离子有Fe2+、Fe3+,验证所含离子所用的试剂是高锰酸钾溶液检验亚铁离子,用硫氰酸钾溶液遇到铁离子形成血红色溶液,
(2)①根据装置图可知,A装置是制备氨气的.由于生成的氨气中含有水蒸气,所以需要干燥,选用碱石灰干燥.氨气的密度小于空气的,且氨气极易溶于水,所以应该用向下排空气法收集,且需要将多余的氨气进行吸收,与i相连的漏斗的作用是防止倒吸.
②为探究氨气和氯气的反应,要用A装置制氯气,制得的氯气中含有氯化氢和水等杂质,要用饱和食盐水和浓硫酸除去,根据装置C的结构可知,密度小的气体从导管2进,密度大的气体从导管1进,这样两种气体才能充分接触;
(3)消耗盐酸的物质的量是0.01L×0.5mol/L=0.005mol,则根据方程式NaOH+HCl=NaCl+H2O可知,与盐酸反应的氢氧化钠是0.005mol.氢氧化钠的物质的量是0.1L×0.25mol/L=0.025mol,则与硫酸铜反应的氢氧化钠是0.025mol-0.005mol=0.020mol.则根据方程式2NaOH+CuSO4=Cu(OH)2↓+Na2SO4可知,硫酸铜的物质的量是0.020mol÷2=0.010mol,所以根据原子守恒可知,铜矿石中Cu2(OH)2CO3的物质的量是0.010mol÷2=0.005mol,计算得到质量分数.
解答 解:双氧水具有强氧化性,能把亚铁离子氧化生成铁离子,所以在溶液A中加入H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(1)Cu2(OH)2CO3以及Fe、Si的化合物与稀硫酸反应生成硫酸铜、硫酸亚铁、硫酸铁.二氧化硅与稀硫酸不反应,所以溶液A中除含有Cu2+外,还可能含有的金属离子有Fe2+、Fe3+,验证所含离子所用的试剂是高锰酸钾溶液检验亚铁离子,用硫氰酸钾溶液遇到铁离子形成血红色溶液,
故答案为:Fe2+、Fe3+,酸性高锰酸钾溶液、KSCN溶液;
(2)①根据装置图可知,A装置是制备氨气的.由于生成的氨气中含有水蒸气,所以需要干燥,选用碱石灰干燥.氨气的密度小于空气的,且氨气极易溶于水,所以应该用向下排空气法收集,且需要将多余的氨气进行吸收,因此正确的操作顺序是a→g、h→e、d→i;氨气极易溶于水,因此与i相连的漏斗的作用是防止倒吸,
故答案为:ghed,防止倒吸;
②为探究氨气和氯气的反应,要用A装置制氯气,制得的氯气中含有氯化氢和水等杂质,要用饱和食盐水和浓硫酸除去,所以装置B中的药品依次是饱和食盐水、浓硫酸,根据装置C的结构可知,密度小的气体从导管2进,密度大的气体从导管1进,这样两种气体才能充分接触,所以关闭2,先向烧瓶中通入氯气,
故答案为:饱和食盐水、浓硫酸;氯气;
(3)消耗盐酸的物质的量是0.01L×0.5mol/L=0.005mol,则根据方程式NaOH+HCl=NaCl+H2O可知,与盐酸反应的氢氧化钠是0.005mol.氢氧化钠的物质的量是0.1L×0.25mol/L=0.025mol,则与硫酸铜反应的氢氧化钠是0.025mol-0.005mol=0.020mol.则根据方程式2NaOH+CuSO4=Cu(OH)2↓+Na2SO4可知,硫酸铜的物质的量是0.020mol÷2=0.010mol,所以根据原子守恒可知,铜矿石中Cu2(OH)2CO3的物质的量是0.010mol÷2=0.005mol,所以Cu2(OH)2CO3质量分数为$\frac{0.005mol×222g/mol}{1.25g}$×100%=88.8%.
故答案为:88.8%.
点评 本题考查了混合物质的分离提纯,实验过程分析判断,注意仪器的应用和含量的计算,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 乙烯、苯、环己烷都属于脂肪烃 | B. | 苯、环戊烷、环己烷同属于芳香烃 | ||
| C. | 乙烯、乙炔同属于烯烃 | D. |  、 、 、 、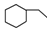 同属于环烷烃 同属于环烷烃 |
| A. | 2H2O$\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Cl2+H2O═HC1+HC1O | D. | 2F2+2H2O═4HF+O2 |
| A. | 在常温常压下,0.5 mol任何气体的体积都必定是11.2 L | |
| B. | 在标准状况下,1 mol任何物质的体积都约是22.4 L | |
| C. | 常温常压下,1 mol任何气体的体积都约是22.4 L | |
| D. | 在标准状况下,0.5 mol CO2所占有的体积约是11.2 L |
| A. | 增大压强,活化分子数增加,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增加,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能、反应速率加快,但是活化分子百分数不变 |
| A. | BaCl2、Na2CO3、NaOH、盐酸 | B. | NaOH、BaCl2、Na2CO3、盐酸 | ||
| C. | Na2CO3、NaOH、BaCl2、盐酸 | D. | BaCl2、NaOH、Na2CO3、盐酸 |
 图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).
图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).