题目内容
9.实验室制取乙烯的装置如图1所示,请根据图示回答下列问题: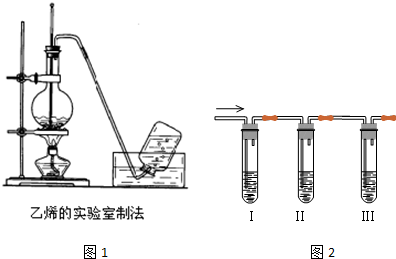
(1)在烧瓶中加入20ml乙醇和浓硫酸(体积比约为1:3)的混合液,然后放入几片碎瓷片,加热混合液,使液体温度迅速升到170℃.
①配制20ml体积比约为1:3的乙醇和浓硫酸的混合液的方法是在烧杯中加入5mL 95%的乙醇,然后滴加15mL浓硫酸,边加边振荡;
②加几片碎瓷片的目的是避免混合液在受热时暴沸;
③反应的化学方程式为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,该反应属于消去反应(填反应类型);若实验中温度控制在140℃左右,则产物是乙醚(填物质的名称),此时的反应类型属于取代反应(填反应类型)
(2)乙醇和浓硫酸混合液加热时会出现炭化现象,因此反应中生成的乙烯中会含有CO2和SO2杂质气体.某化学课外兴趣小组欲利用图2装置检验乙烯的化学性质,试回答下列问题:
①装置I中盛有NaOH溶液,目的是除去CO2和SO2杂质气体,反应的离子方程式为CO2+2OH?=CO32-+H2O、SO2+2OH?=SO32?+H2O;
②装置II中盛有品红溶液,目的是检验SO2是否除尽;
③装置Ⅲ中盛有溴的四氯化碳溶液,可观察到的现象是溶液褪色;
反应的化学方程式是CH2=CH2+Br2→CH2BrCH2Br.
分析 (1)①混合液体先加密度小的,再加密度大的液体;
②碎瓷片可防止液体剧烈沸腾;
③乙醇发生消去反应生成乙烯,若控制温度为140℃发生副反应生成乙醚;
(2)反应中生成的乙烯中会含有CO2和SO2杂质气体,检验乙烯的化学性质由图可知,I中为NaOH可吸收二氧化硫、二氧化碳,II中品红检验二氧化硫除尽,Ⅲ中盛有溴的四氯化碳溶液褪色,可知乙烯与溴发生加成反应.
解答 解:(1)①配制20ml体积比约为1:3的乙醇和浓硫酸的混合液的方法是在烧杯中加入5mL 95%的乙醇,然后滴加15mL浓硫酸,边加边振荡,
故答案为:在烧杯中加入5mL 95%的乙醇,然后滴加15mL浓硫酸,边加边振荡;
②加几片碎瓷片的目的是避免混合液在受热时暴沸,
故答案为:避免混合液在受热时暴沸;
③反应的化学方程式为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,为消去反应;若实验中温度控制在140℃左右,则产物是乙醚,此时的反应类型属于取代反应,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;消去反应;乙醚;取代反应;
(2)①装置I中盛有NaOH溶液,目的是除去CO2和SO2杂质气体,反应的离子方程式为CO2+2OH?=CO32-+H2O、SO2+2OH?=SO32?+H2O,
故答案为:除去CO2和SO2杂质气体;CO2+2OH?=CO32-+H2O、SO2+2OH?=SO32?+H2O;
②装置II中盛有品红溶液,目的是检验SO2是否除尽,
故答案为:检验SO2是否除尽;
③装置Ⅲ中盛有溴的四氯化碳溶液,可观察到的现象是溶液褪色;反应的化学方程式是CH2=CH2+Br2→CH2BrCH2Br,
故答案为:溶液褪色;CH2=CH2+Br2→CH2BrCH2Br.
点评 本题考查有机物的制备实验及性质实验,为高频考点,把握反应原理、实验装置的作用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意有机物性质的应用,综合性较强,题目难度中等.

| A. | O | B. | S | C. | P | D. | C |
| A. | 增大压强 | B. | 升高温度 | C. | 增大CH4浓度 | D. | 更换高效催化剂 |
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
②1000s内N2O5的分解速率为:0.00252mol/(L•s).
③若每有1mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol.

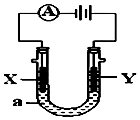 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: