题目内容
15.实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示: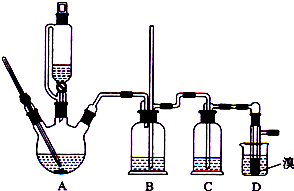
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)写出该实验过程中发生的所有主要反应的化学方程式CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br-Br→CH2Br-CH2Br.
(2)在此制各实验中,要尽可能迅速地把反应温度170℃左右,其最主要目的是d.(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去(填实验现象).
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层
(6)若产物中有少量未反应的Br2,最好用b洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚.可用蒸馏的方法除去.
(8)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
分析 (1)三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下加热到170℃产生乙烯;乙烯分子含有C=C双键,能与溴发生加成反应,D中发生乙烯与溴单质反应生成1,2-二溴乙烷;
(2)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚;
(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳;生成的酸性气体为SO2、CO2可以和氢氧化钠反应;
(4)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色;
(5)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大;
(6)因Br2能与NaOH溶液反应,且1,2-二溴乙烷与水互不相溶,所以用氢氧化钠溶液吸收Br2,采用的仪器是分液漏斗.
(7)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(8)溴易挥发,冷却防止溴大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
解答 解:(1)三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,乙烯含有不饱和键C=C双键,能卤素单质发生加成反应,D中乙烯和溴加成生成1,2-二溴乙烷,反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,
故答案为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br-Br→CH2Br-CH2Br;
(2)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,可能迅速地把反应温度提高到170℃左右,其最主要目的是:减少副产物乙醚生成;
故答案为:d;
(3)浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,二氧化碳在水中溶解度小,高锰酸钾不能吸收二氧化碳,浓硫酸既不能吸收二氧化碳,也不能吸收二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应:SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,
故答案为:c;
(4)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束,
故答案为:溴的颜色完全褪去;
(5)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,有机层在下层,
故答案为:下;
(6)a.溴更易溶液1,2-二溴乙烷,用水无法除去溴,故a错误;
b.常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,故b正确;
c.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故c错误;
d.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故d错误,
故答案为:b.
(7)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(8)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会使其凝固而使气路堵塞,导致B中长导管内液面上升,
故答案为:冷却可避免溴的大量挥发;产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验原理、混合物分离提纯实验等为解答的关键,侧重分析与实验能力的考查,题目难度中等.

 新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.
新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.【查阅资料】在不同温度下,a-Fe粉末与水蒸气反应的固体产物不同;温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4.
【探究一】
(1)甲同学用如左图装置进行a-Fe粉末与水蒸气的反应,湿棉花的作用是提供水蒸气作为反应物;写出该反应的化学方程式:Fe+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeO+H2;
【探究二】
乙同学用如右图装置进行a-Fe粉末与水蒸气反应并验证产物.
(2)实验前必须对整套装置进行的操作是检查气密性;试管a中的物质是水
(3)水槽中的试管里收集的气体是氢气;如果要点燃该气体,必须进行的操作是验纯;
【探究三】乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 取少量反应后的黑色粉末X,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;产生少量气泡 |
| Ⅱ | 向实验I中得到的溶液滴加2滴KSCN溶液,振荡 | 溶液没有出现红色 |
【探究反思】
(5)乙同学称取5.60gFe粉,用右图的装置反应一段时候后,停止加热.在干燥器中冷却后,称得6.88g.取冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3物质的量,最终确定产物的成分.若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为0.08mol.
①需要用硫酸来酸化KMnO4溶液(填字母)A.硫酸 B.盐酸 C.硝酸
褪色所需时间tA<tB(填“>”、“=”或“<”).
②写出该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol/LKMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.
当反应中生成的锰离子具有催化作用,所以随后褪色会加快,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下:
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
④误差分析:下列操作会导致测定结果偏高的是ACD.
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | 溶解度 /(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL圆底烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填“a”或“b”)端管口通入.
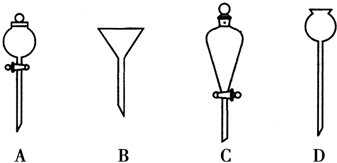
(2)进行分液操作时,使用的漏斗是C(填选项).
(3)仪器A中乙酸和正丁醇制备乙酸正丁酯的化学方程为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)步骤①“不断分离除去反应生成的水”的目的是使用分水器分离出水,使平衡正向移动,提高反应产率.
(5)步骤②中用10% Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(6)乙酸正丁酯的产率为65%.
| A. | 物质的量浓度c(甲)=10c(乙) | |
| B. | 甲中由水电离产生的H+的物质的量浓度和乙的相等 | |
| C. | 中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲) | |
| D. | 甲中的c(OH-)为乙中c(OH-)的10倍 |