题目内容
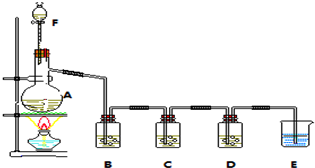
5. 新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.
新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.【查阅资料】在不同温度下,a-Fe粉末与水蒸气反应的固体产物不同;温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4.
【探究一】
(1)甲同学用如左图装置进行a-Fe粉末与水蒸气的反应,湿棉花的作用是提供水蒸气作为反应物;写出该反应的化学方程式:Fe+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeO+H2;
【探究二】
乙同学用如右图装置进行a-Fe粉末与水蒸气反应并验证产物.
(2)实验前必须对整套装置进行的操作是检查气密性;试管a中的物质是水
(3)水槽中的试管里收集的气体是氢气;如果要点燃该气体,必须进行的操作是验纯;
【探究三】乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 取少量反应后的黑色粉末X,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;产生少量气泡 |
| Ⅱ | 向实验I中得到的溶液滴加2滴KSCN溶液,振荡 | 溶液没有出现红色 |
【探究反思】
(5)乙同学称取5.60gFe粉,用右图的装置反应一段时候后,停止加热.在干燥器中冷却后,称得6.88g.取冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3物质的量,最终确定产物的成分.若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为0.08mol.
分析 [探究一]加热温度较低,应生成FeO和氢气;
[探究二]用酒精喷灯加热,温度较高,可生成四氧化三铁和氢气,装置中试管a用于提供水蒸气,点燃氢气时应先验纯,防止爆炸;
[探究三]生成气体为氢气,说明铁粉过量,则溶液中不存在铁离子,加入KSCN溶液不显红色;
【探究反思】根据铁粉的质量和生成物的质量,确定反应后固体中铁的质量,结合2Fe3++Fe=3Fe2+确定氯化铁的物质的量.
解答 解:(1)加热试管使湿棉花中的水蒸发,湿棉花主要是提供反应物水蒸气,与铁粉发生反应,因加热温度较低,应生成FeO和氢气,方程式为,
故答案为:提供水蒸气作为反应物;Fe+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeO+H2;
(2)有气体参加反应,则实验时应先检验装置的气密性,装置中试管a用于提供水蒸气,试管a中的物质是水;
故答案为:检查气密性;水;
(3)用酒精喷灯加热,温度较高,可生成四氧化三铁和氢气,点燃氢气时应先验纯,防止爆炸,
故答案为:氢气;验纯;
(4)生成气体为氢气,说明铁粉过量,则溶液中不存在铁离子,加入KSCN溶液不显红色,则不能确定是否含有Fe3O4,因发生2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(5)乙同学称取5.60gFe粉,用右图的装置反应一段时候后,停止加热.在干燥器中冷却后,称得6.88g,增加的质量为氧元素的质量,即n(O)=$\frac{6.88g-5.60g}{16g/mol}$=0.08mol,根据关系式Fe3O4~4O~3Fe计算,消耗0.06molFe,即剩余0.04mol铁与氯化铁反应,则由2Fe3++Fe=3Fe2+可知消耗0.08mol氯化铁,
故答案为:0.08.
点评 本题考查铁及其化合物的性质实验,为高考常见题型和高频考点,侧重学生的分析、实验和计算能力的考查,注意把握实验的原理、操作方法,难度中等.

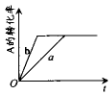 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是 ( )| A. | 增大A的浓度或减少C的浓度 | |
| B. | 缩小容器的容积或加入催化剂 | |
| C. | 升高温度或增大压强 | |
| D. | 由a变成b,A和B的物质的量与C、D的物质的量相等 |
部分阳离子以氢氧化物形式沉淀时的pH如表:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
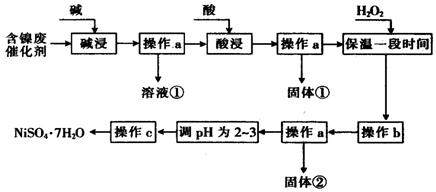
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2≤PH<7.1.
| A. | Cl2 | B. | CO2 | C. | O2 | D. | NH3 |
| A. | 是熵减反应 | B. | 是熵增效应大于能量效应 | ||
| C. | 是吸热反应 | D. | 是放热反应 |
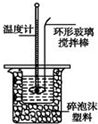 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在同温度下反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数K=1.
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=4/Vt1mol/(L•min)
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,
写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566 kJ/mol.
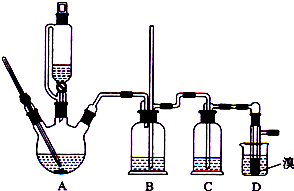
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)写出该实验过程中发生的所有主要反应的化学方程式CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br-Br→CH2Br-CH2Br.
(2)在此制各实验中,要尽可能迅速地把反应温度170℃左右,其最主要目的是d.(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去(填实验现象).
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层
(6)若产物中有少量未反应的Br2,最好用b洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚.可用蒸馏的方法除去.
(8)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.