题目内容
3.25℃时,下列有关溶液中微粒的物质的量浓度关系错误的是( )| A. | 0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) | |
| C. | Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+) | |
| D. | 0.1mol/LNH4Cl与0.1mol/L氨水溶液等体积混合:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
分析 A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合,生成等物质的量CH3COOH和NaCl;
B.根据物料守恒分析;
C.根据电荷守恒分析;
D.NH3•H2O的电离程度大于NH4+的水解程度.
解答 解:A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合,生成等物质的量CH3COOH和NaCl,钠离子与氯离子不水解,二者的浓度相同,即c(Na+)=c(Cl-),CH3COOH是弱酸在溶液中部分电离,所以c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),故A正确;
B.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合,钠离子的总浓度是C的最浓度的1.5倍,所以溶液中:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故正确;
C.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸)生成等物质的量浓度的NaHC2O4和NaCl,溶液中存在电荷守恒为:2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),故C正确;
D.0.1mol/LNH4Cl与0.1mol/L氨水溶液等体积混合,溶液显碱性,NH3•H2O的电离程度大于NH4+的水解程度,所以溶液中c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-),故D错误.
故选D.
点评 本题考查了混合溶液中离子浓度大小比较,题目难度中等,注意把握弱电解质的电离和盐的水解、以及电荷守恒和物料守恒的应用,侧重于考查学生的分析能力.

练习册系列答案
相关题目
13.下列关于反应能量的说法正确的是( )
| A. | 若反应A(s)=B(s);△H<O,则说明A物质比B物质稳定 | |
| B. | Zn(s)+CuSO4 (aq)═ZnSO4 (aq)+Cu(s);△H=-216kJ•mol-1.则反应物总能量<生成物总能量 | |
| C. | 101kPa时,2H2(g)+O2(g)═2H2O(l);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-l | |
| D. | H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
11.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了不同的方法,其中不可行的是( )
| A. | 将少量的两种白色固体分别加入1 mol/L的盐酸中,看有无气泡产生 | |
| B. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加BaCl2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
8.电子工业制造光电管时,需要一种强光照射就失电子,从而接通电路的材料,制造该材料的物质是( )
| A. | 放射元素 | B. | ⅦA族元素 | C. | 卤化银 | D. | ⅠA族元素 |
15.我国规定饮用水质量标准必须符合下列要求:
以下是源水处理成自来水的工艺流程示意图:
源水→曝气池$\stackrel{加石灰}{→}$一级沉降池$→_{通入CO_{2}}^{凝聚剂井}$二级沉降池$\stackrel{气体A}{→}$过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式Mg2++OH-=Mg(OH)2↓.
(2)凝聚剂除去悬浮固体颗粒的过程③(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀.
(3)通入二氧化碳的目的是将Ca2+除去和调整溶液中的pH达到饮用水质量标准.
(4)气体A的作用是杀菌消毒.这种作用是基于气体A和水反应的产物具有强氧化性.
(5)下列物质中,①和③可以作为气体A的代用品.(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
| pH | 6.5~6.8 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/L |
源水→曝气池$\stackrel{加石灰}{→}$一级沉降池$→_{通入CO_{2}}^{凝聚剂井}$二级沉降池$\stackrel{气体A}{→}$过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式Mg2++OH-=Mg(OH)2↓.
(2)凝聚剂除去悬浮固体颗粒的过程③(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀.
(3)通入二氧化碳的目的是将Ca2+除去和调整溶液中的pH达到饮用水质量标准.
(4)气体A的作用是杀菌消毒.这种作用是基于气体A和水反应的产物具有强氧化性.
(5)下列物质中,①和③可以作为气体A的代用品.(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
12.四种短周期元素A、B、C、D的性质或结构信息如下.
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题.
(1)甲、乙、丙中含有的共同元素是氢(填名称).
(2)B元素在周期表中的位置为第2周期ⅣA族.
(3)上述元素的原子M层有一个未成对p电子的是Cl(填元素符号).
(4)丙的电子式为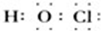 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
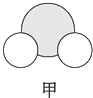 | 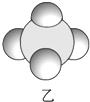 |  |
| 是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
(1)甲、乙、丙中含有的共同元素是氢(填名称).
(2)B元素在周期表中的位置为第2周期ⅣA族.
(3)上述元素的原子M层有一个未成对p电子的是Cl(填元素符号).
(4)丙的电子式为
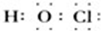 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl. 
 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.