题目内容
14.碳在O2中燃烧产生CO和CO2的混合气体,利用从混合气体中得到的纯净CO和铁锈反应,测定铁锈样品的组成(假定铁锈中只有Fe2O3•nH2O和Fe两种成份),有以下几种仪器供选择:
(1)B仪器的名称洗气瓶.
(2)B中盛放的液态试剂是浓H2SO4.
(3)仪器的连接顺序D→B→A→C(填字母序号).
(4)安装仪器后,点燃酒精灯之前进行的两步操作是:
①检查装置气密性,②通入混合气体一段时间排除体系的空气.
(5)碱石灰的作用是防止空气中的水进入体系影响实验结果.
(6)尾气的处理方法点燃.
(7)准确称量样品20.72 g置于硬质玻璃管中,充分反应后冷却称量,假设每步都完全反应,硬质玻璃管中剩余固体质量为16.64 g,C中浓H2SO4增重2.16 g,则n=3.
(8)下列情况会使测定结果n偏大的是ab.
a.缺少装置B
b.缺少装置C中的碱石灰
c.反应后固体中有少量Fe2O3•nH2O.
分析 要得到纯净CO应先除CO2,用D装置,再除H2O用B装置,杂质除净用A装置进行CO和铁锈反应,用C吸收产生的H2O,其中浓H2SO4增重即为H2O的质量,碱石灰是防止空气中水蒸气进入装置C影响测定结果,
(1)B是除杂用的洗气瓶,导气管长进短出;
(2)B中是除取去一氧化碳气体中的H2O用浓H2SO4.
(3)要得到纯净CO应先除CO2,用D装置,再除H2O用B装置,杂质除净用A装置进行CO和铁锈反应,用C吸收产生的H2O,其中浓H2SO4增重即为H2O的质量;
(4)只有验证气密性好,才能加药品开始实验为,为防止空气中O2和Fe反应,必须先除掉空气中O2;
(5)碱石灰防止空气中CO2和水进入装置影响测定结果;
(6)CO用点燃除去产物无污染;
(7)Fe2O3?nH2O和Fe共20.72 g剩余16.64 g,减少了4.08 g,减少的是nH2O和Fe2O3中氧的质量,C中增重是H2O,$\frac{n(O)}{n({H}_{2}O)}$=$\frac{\frac{4.08-2.16}{16}}{\frac{2.16}{18}}$=1,Fe2O3中氧原子个数是3个,和H2O个数1:1,所以n=3;
(8)缺少B则有水进入A,最后被C吸收使H2O质量多了,缺少C中碱石灰,则有空气中H2O进入浓H2SO4.
解答 解:(1)分析B仪器的形状和作用可知,装置是用来除去混合气体中杂质气体的仪器,名称为:洗气瓶,使用时导气管长进短出.
故答案为:洗气瓶;
(2)分析过程可知B装置是除去一氧化碳气体中的水蒸气,所以B中除H2O的试剂用浓H2SO4,
故答案为:浓硫酸;
(3)要得到纯净CO应先除去混合气体中的CO2,用D装置中的氢氧化钠吸收,再通过B装置中 的浓硫酸除去气体中H2O,杂质除净后用A装置进行CO和铁锈反应生成铁和二氧化碳,装置C中浓硫酸吸收产生的H2O,其中浓H2SO4增重即为H2O的质量,碱石灰是减少空气中水蒸气被装置C吸收,装置连接顺序为DBAC,
故答案为:D B A C;
(4)实验是气体反应和反应产物的测定,安装仪器后,点燃酒精灯之前进行的两步操作是,只有验证气密性好,才能加药品开始实验,为防止空气中O2和Fe反应,必须先除掉空气中O2,通入混合气体一段时间排除体系的空气,
故答案为:检查装置气密性,通入混合气体一段时间排除体系的空气;
(5)碱石灰是防止空气中CO2和水进入装置C影响测定结果,
故答案为:防止空气中的水进入体系影响实验结果;
(6)CO气体难溶于水,和溶液一般不能发生反应,所以用点燃方法除去产物,生成二氧化碳无污染,
故答案为:点燃;
(7)Fe2O3?nH2O和Fe共20.72 g剩余16.64 g,减少了4.08 g,减少的是nH2O和Fe2O3中氧的质量,C中增重是H2O,$\frac{n(O)}{n({H}_{2}O)}$=$\frac{\frac{4.08-2.16}{16}}{\frac{2.16}{18}}$=1,Fe2O3中氧原子个数是3个,和H2O个数1:1,所以n=3,
故答案为:3;
(8)a.缺少B则有水进入A,最后被C吸收使H2O质量多了,结果偏高;
b.缺少C中碱石灰,则有空气中H2O进入浓H2SO4,导致水的质量增大,测定结果偏高;
c.反应后固体中有少量Fe2O3•nH2O,结晶水合物未全部分解,导致生成水减小,测定结果偏低,
故答案为:ab.
点评 本题考查化学实验中仪器连接和除杂质以及计算,主要是物质组成的实验探究,注意仪器的使用和作用分析判断,题目难度中等.

①Fe(SCN)3溶液中加入固体KSCN后颜色变深
②棕红色NO2加压后颜色先变深后变浅
③SO2催化氧化成SO3的反应,往往需要使用催化剂
④H2、I2、HI平衡混和气加压后颜色变深
⑤光照氯水,颜色变浅
⑥向盛有NO2的集气瓶中投入活性炭,颜色变浅
⑦加热氯化铁溶液,溶液变红.
| A. | ②③④ | B. | ①②⑥ | C. | ④⑤⑦ | D. | ③④⑥ |
| A. | 米酒变酸的过程涉及了氧化反应 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 含5个碳原子的有机物分子中最多可形成4个碳碳单键 | |
| D. | 蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程 |
| A. | 将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| B. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| C. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| D. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c (H+)+c(HA) |
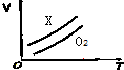 如图表示ag O2与a gX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示ag O2与a gX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )| A. | C3H6(气) | B. | CH4 | C. | CO2 | D. | NO |
| A. | 稀醋酸中加入少量冰醋酸能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的盐酸与氨水混合后,溶液pH=7 | |
| C. | 0.1 mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) | |
| D. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
| A. | 0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) | |
| C. | Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+) | |
| D. | 0.1mol/LNH4Cl与0.1mol/L氨水溶液等体积混合:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| A. | 中和热测定 | B. | 中和滴定 | ||
| C. | 过滤 | D. | 物质的量浓度溶液配制 |