题目内容
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )


| A、加入Na2SO4可使溶液由a点变到b点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b点有BaSO4沉淀生成 |
| D、a点对应的Ksp大于c点对应的Ksp |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:该图中的是平衡曲线,线上的任意点都是平衡状态,b和d不是平衡状态,
A、加人Na2SO4后平衡逆向移动,但仍在线上移动;
B、蒸发使离子浓度增大,d点不可能到c点;
C、b点表示Qc>Ksp,溶液过饱和;
D、Ksp与温度有关,a和c的Ksp相等
A、加人Na2SO4后平衡逆向移动,但仍在线上移动;
B、蒸发使离子浓度增大,d点不可能到c点;
C、b点表示Qc>Ksp,溶液过饱和;
D、Ksp与温度有关,a和c的Ksp相等
解答:
解:A、硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移,c(Ba2+)应降低,故A错误;
B、d点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,所以不能使溶液由d点变到c点,故B错误;
C、b点表示Qc>Ksp,溶液过饱和,会有沉淀析出,故C正确;
D、Ksp是溶度积常数,只随着温度的改变而改变,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故D错误;
故选C.
B、d点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,所以不能使溶液由d点变到c点,故B错误;
C、b点表示Qc>Ksp,溶液过饱和,会有沉淀析出,故C正确;
D、Ksp是溶度积常数,只随着温度的改变而改变,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故D错误;
故选C.
点评:本题考查沉淀溶解平衡,题目难度不大,注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积KSP的概念.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在Na2CO3溶液中,下列关系式错误的是( )
| A、c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B、c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| C、c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、c(CO32-)>c(OH-)>c(HCO3-) |
 在25℃时,向弱酸HAc中逐滴滴人NaOH溶液,在不同的pH下,HAc分子与Ac-离子的含量如图所示,则下列说法正确的是( )
在25℃时,向弱酸HAc中逐滴滴人NaOH溶液,在不同的pH下,HAc分子与Ac-离子的含量如图所示,则下列说法正确的是( )| A、当pH<2.6时,HAc不电离 |
| B、O点时.HAc恰好与NaOH完全反应 |
| C、pH=6.4时溶液中溶质只有NaAc |
| D、50℃,曲线交点O点pH<4.76 |
下列各组离子在指定条件下,能大量共存的是( )
| A、在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B、使pH试纸变深蓝的溶液中:K+、CO32-、Na+、AlO2- |
| C、在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- |
| D、能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- |
关于0.1mol?L-1 NH4Cl溶液,下列说法正确的是( )
| A、c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| B、c(H+)=c(NH3?H2O)+c(OH-) |
| C、加水稀释,溶液中所有离子的浓度均减小 |
| D、向溶液中加入少量CH3COONa固体,NH4+的水解程度增大 |
NA为阿伏伽德罗常数,下列说法正确的是( )
| A、标准状况下,22.4 LH2O含有的水分子数为NA |
| B、22gCO2含有的CO2分子数为0.5NA |
| C、44gCO2气体含有的氧原子数为2NA |
| D、40g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L |
下列离子方程式正确的是( )
| A、钠投入水中:Na+H2O=Na++OH-+H2↑ |
| B、HCl溶液与NaOH溶液反应:H++OH-=H2O |
| C、石灰石溶于盐酸中:CO32-+H+=CO2↑+H2O |
| D、Zn与H2SO4溶液反应:Zn+2H+=Zn2++H2↑ |
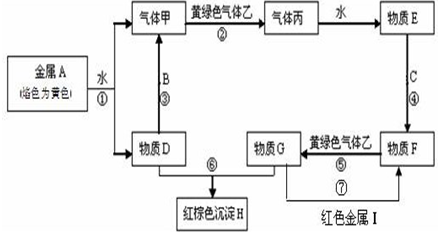 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).