题目内容
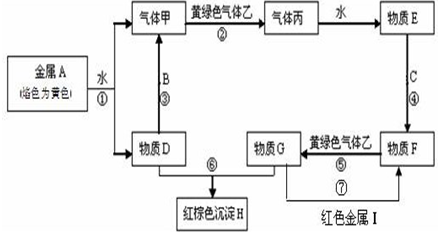 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,金属B既能跟酸又能跟强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A
(2)写出下列反应化学方程式:
反应①
反应③
反应⑥
考点:无机物的推断
专题:推断题
分析:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.金属C在地壳中的含量居第四位,则C为Fe,与盐酸反应得到F,F与氯气反应得到G,G与氢氧化钠与得到红褐色沉淀HFe(OH)3,可知F为FeCl2,G为FeCl3,结合物质的性质解答该题.
解答:
解:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.金属C在地壳中的含量居第四位,则C为Fe,与盐酸反应得到F,F与氯气反应得到G,G与氢氧化钠与得到红褐色沉淀H为Fe(OH)3,可知F为FeCl2,G为FeCl3,
(1)由上述分析可知,A为Na、B为Al、C为Fe、F为FeCl2、H为Fe(OH)3、乙为Cl2,
故答案为:Na;Al;Fe;FeCl2;Fe(OH)3;Cl2;
(2)反应①是金属钠和水反应生成氢氧化钠和氢气,反应方程式:2Na+2H2O=2NaOH+H2↑,
反应③是Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
反应⑥是氯化铁与氢氧化钠反应生成氢氧化铁沉淀与氯化钠,反应方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,
故答案为:2Na+2H2O=2NaOH+H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
(1)由上述分析可知,A为Na、B为Al、C为Fe、F为FeCl2、H为Fe(OH)3、乙为Cl2,
故答案为:Na;Al;Fe;FeCl2;Fe(OH)3;Cl2;
(2)反应①是金属钠和水反应生成氢氧化钠和氢气,反应方程式:2Na+2H2O=2NaOH+H2↑,
反应③是Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
反应⑥是氯化铁与氢氧化钠反应生成氢氧化铁沉淀与氯化钠,反应方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,
故答案为:2Na+2H2O=2NaOH+H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
点评:本题是无机框图推断题,考查物质推断与性质,难度中等,掌握元素化合物的性质是解题的关键,注意特殊的颜色与特殊反应是推断的突破口.

练习册系列答案
相关题目
普通锌锰干电池的外壳是锌筒,内置一个碳棒作电极,工作时发生的反应为:
2Zn+4NH4Cl+4MnO2═Zn(NH3)4Cl2+ZnCl2+2Mn2O3+2H2O
下列有关说法不正确的是( )
2Zn+4NH4Cl+4MnO2═Zn(NH3)4Cl2+ZnCl2+2Mn2O3+2H2O
下列有关说法不正确的是( )
| A、干电池的负极是锌筒 |
| B、MnO2在碳棒上发生还原反应 |
| C、闲置时间过长干电池也会失去供电能力 |
| D、工作时电解液中的NH4+移向负极 |
 如图所示的两个实验装置,溶液的体积均为200mL.开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液和体积变化,下列叙述中正确的是( )
如图所示的两个实验装置,溶液的体积均为200mL.开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液和体积变化,下列叙述中正确的是( )| A、产生气体的体积:①>② |
| B、溶液的pH变化:①减小,②增大 |
| C、电极上生成物质的质量:①=② |
| D、电极反应式:①中阳极2Cl--2e-═Cl2↑,②中负极2H++2e-═H2↑ |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )


| A、加入Na2SO4可使溶液由a点变到b点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b点有BaSO4沉淀生成 |
| D、a点对应的Ksp大于c点对应的Ksp |

 、-CHO
、-CHO