题目内容
13.将17.9g由Cu、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7g.另取等质量的合金溶于过量稀HNO3中,生成了6.72L NO(标准状况下),向反应后的溶液中加入过量的NaOH溶液,则沉淀的质量为( )| A. | 22.1 g | B. | 25.4 g | C. | 33.2g | D. | 无法计算 |
分析 根据电子守恒计算出金属失去电子的物质的量,根据应中金属失去电子的物质的量等于生成碱的氢氧根离子的物质的量计算生成沉淀的质量.
解答 解:将合金溶于过量稀硝酸中,分别生成Cu2+、Fe3+、Mg2+离子,同时生成了6.72L NO(标准状况下),根据电子守恒,金属共失去电子的物质的量为:$\frac{6.72L}{22.4L/mol}$×3=0.9mol,
反应中金属失去电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH-)=0.9mol,
所以反应后沉淀的质量等于:17.9g+0.9mol×17g/mol=33.2g,
故选C.
点评 本题考查混合物反应的计算,题目难度不大,注意从守恒的角度做题较为简单,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
19.在密闭容器中A与B反应生成C,已知:2v(B)=3v(A),3v(C)=2v(B).则此反应为( )
| A. | A+3B=2C | B. | 3A+B=2C | C. | A+B=C | D. | 2A+3B=2C |
8.把蘸有浓盐酸的玻璃棒靠近装有氨水的试剂瓶口,为了使现象明显,可先往瓶中加入一种物质,该物质可以选用下列物质中的( )
①浓硫酸 ②固体烧碱 ③固体碳酸钙 ④生石灰 ⑤固体NH4Cl ⑥固体食盐.
①浓硫酸 ②固体烧碱 ③固体碳酸钙 ④生石灰 ⑤固体NH4Cl ⑥固体食盐.
| A. | ①② | B. | ②③④ | C. | ②④⑤ | D. | ①③⑥ |
18.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 用玻璃杯蘸取某溶液进行焰火反应实验 | 火焰呈黄色 | 溶液中含有Na+ |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗做完眼镜反应的试管 | 用FeCl3溶液清洗比Fe2(SO4)3溶液清洗得干净 | Fe3+氧化银单质的过程可能是一个可逆过程: Fe3++Ag?Fe2++Ag+ |
| A. | A | B. | B | C. | C | D. | D |
2.有四种微粒的结构示意图如图,下列说法错误的是( )
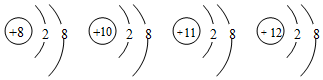
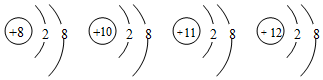
| A. | 它们属于不同种元素 | |
| B. | 它们的核外电子排布相同 | |
| C. | 它们都是离子 | |
| D. | 它们都具有稀有气体原子的稳定结构 |
3.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 含lmolH2SO4的浓硫酸与足量铜在加热条件下反应,转移的电子总数为NA | |
| B. | 0.1 L0.5mol/LCH3COOH 溶液中含有的氢离子为0.05NA | |
| C. | 粗铜精炼时阳极质量减少6.4g,则外电路上通过0.2NA电子 | |
| D. | 1molCH3COONa和少量CH3COOH溶于水所得到的中性溶液中,CH3COO-的数目为NA |
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: