题目内容
2.有四种微粒的结构示意图如图,下列说法错误的是( )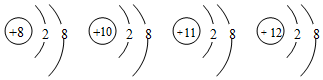
| A. | 它们属于不同种元素 | |
| B. | 它们的核外电子排布相同 | |
| C. | 它们都是离子 | |
| D. | 它们都具有稀有气体原子的稳定结构 |
分析 结构示意图书写:圆内数字为原子的质子数,符号表示电性,圆外的弧线为电子层,弧线上的数字为该层上的电子数,离圆最近的弧线表示第一层,依次向外为第二层等,图示四种微粒分别为:氧离子、氖原子、钠离子、镁离子.
A.元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同;
B.它们的核外电子排布相同;
C. 为氖原子;
为氖原子;
D.稀有气体原子的稳定结构是最外层电子数为8(氦原子为2).
解答 解:A.四种微粒质子数分别为8、10、11、12,分别为:氧离子、氖原子、钠离子、镁离子,属于不同种元素,故A正确;
B.它们的核外电子数都为10,分两层排布,排布相同,故B正确;
C.四种微粒分别为:氧离子、氖原子、钠离子、镁离子,含有原子,不都是离子,故C错误;
D.四种微粒的最外层都是8,具有稀有气体原子的稳定结构,故D正确;
故选C.
点评 本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.

练习册系列答案
相关题目
13.将17.9g由Cu、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7g.另取等质量的合金溶于过量稀HNO3中,生成了6.72L NO(标准状况下),向反应后的溶液中加入过量的NaOH溶液,则沉淀的质量为( )
| A. | 22.1 g | B. | 25.4 g | C. | 33.2g | D. | 无法计算 |
10.已知NO2和溴蒸气都是红棕色气体,且都有强氧化性,则下列试剂或方法不能将NO2和溴蒸气区别开的是( )
| A. | 向两种气体中加入适量水,振荡 | B. | 将两种气体分别通入AgNO3溶液中 | ||
| C. | 用湿润的淀粉KI试纸检验 | D. | 将两种气体分别通入FeCl2溶液中 |
17.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验事实的解释正确的是( )
| 现象 | 解释 | |
| A | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,一定无K+ |
| B | SO2使酸性高锰酸钾溶液褪色 | SO2具有漂白性 |
| C | 某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| D | 铁加入稀硝酸中有气泡产生 | 铁与稀硝酸发生了置换反应 |
| A. | A | B. | B | C. | C | D. | D |
7.下列说法正确的是( )
| A. | 将AlCl3溶液加热蒸干得到纯净的氯化铝晶体 | |
| B. | 在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的物质的量增加了lmol,则该反应的速率可表示为v(NH3)=0.2mol•L-1•min-1 | |
| C. | 强酸溶液一定比弱酸溶液导电性强 | |
| D. | 钢铁在表层海水中的腐蚀速率大于在潮湿空气中的腐蚀速率 |
14.下列说法不正确的是( )
| A. | 用烧杯可以精确配制0.1mol/L的NaOH溶液 | |
| B. | 用淀粉溶液检验某溶液中是否存在碘单质 | |
| C. | 可利用丁达尔效应区分胶体与溶液 | |
| D. | 用苯可以萃取溴水中的溴单质 |
11.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 吸热反应发生过程中要不断从外界获得能量,放热反应不需要吸收外界能量 | |
| D. | 是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定 |
12.用铜、铬的氧化物作催化剂,HCl制Cl2的原理为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 kJ•mol-1,下列说法正确的是( )
| A. | 平衡时,将生成的水蒸气除去,有利于提高HCl的转化率 | |
| B. | 在恒容绝热容器中进行时,随着反应的进行,气体的压强一定不断减小 | |
| C. | 恒压容器中,反应到平衡后通入惰性气体,平衡不移动 | |
| D. | 平衡时,其他条件不变,增大催化剂用量,反应的平衡常数将变大 |