题目内容
7.六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )| A. | A、C两种元素仅可组成化学式为CA3的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是E>F>C>D | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
分析 六种短周期元素A、B、C、D、E、F的原子序数依次增大,单质F是一种重要的半导体材料,则F为硅元素;B与 F同主族,则B为碳元素;D原子的核电荷数是B原子最外层电子数的2倍,则D的质子数为8,D为氧元素;C的原子序数介于碳元素与氧元素之间,则C为氮元素;E与F同周期,即处于第三周期,E原子序数小于硅元素,A与E同主族,常温下单质A与E的状态不同,A为气体,E为固体,则A、E处于第ⅠA族,故A为氢元素,E为钠元素,据此解答.
解答 解:六种短周期元素A、B、C、D、E、F的原子序数依次增大,单质F是一种重要的半导体材料,则F为硅元素;B与 F同主族,则B为碳元素;D原子的核电荷数是B原子最外层电子数的2倍,则D的质子数为8,D为氧元素;C的原子序数介于碳元素与氧元素之间,则C为氮元素;E与F同周期,即处于第三周期,E原子序数小于硅元素,A与E同主族,常温下单质A与E的状态不同,A为气体,E为固体,则A、E处于第ⅠA族,故A为氢元素,E为钠元素,
A.A为氢元素,C为氮元素,两种元素可组成NH3、N2H4等系列化合物,故A错误;
B.D为氧元素,F为硅元素,二者组成的物质是二氧化硅,性质不活泼,但能与氢氟酸反应,故B错误;
C.同周期随原子序数越大原子半径越小,同主族自上而下原子半径增大,所以Si>C,所以原子半径Na>Si>N>O,即E>F>C>D,故C正确;
D.同周期随原子序数越大元素非金属性增强,同主族自上而下元素非金属性减弱,所以元素的非金属性Si<C<N<O,即D>C>B>F,故D错误.
故选:C.
点评 本题考查结构性质位置关系、元素周期律等,难度不大,推断元素是关键,突破口是单质F是一种重要的半导体材料,注意掌握同主族、同周期元素性质递变规律.

练习册系列答案
相关题目
17.工业上用菱锰矿(MnCO3)为原料制取二氧化锰,其流程示意图如图:
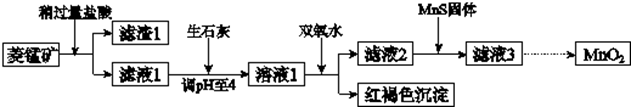
已知:
生成氢氧化物沉淀的pH
如表是三种难溶金属硫化物的溶度积常数(25℃)
回答下列问题:
(1)滤渣1为SiO2;
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS;在CuS、MnS共存的悬浊液中,则$\frac{c(C{u}^{2+})}{c(M{n}^{2+})}$=5.2×10-24.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□4H2O═□Cl2↑+□5MnO2+□8H+;
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+;
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2,检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.

已知:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
(1)滤渣1为SiO2;
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS;在CuS、MnS共存的悬浊液中,则$\frac{c(C{u}^{2+})}{c(M{n}^{2+})}$=5.2×10-24.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□4H2O═□Cl2↑+□5MnO2+□8H+;
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+;
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2,检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
18.下列反应类型与苯和浓硝酸反应类型相同的是( )
| A. | 甲烷和氯气混合并光照 | B. | 乙醇和酸性高锰酸钾溶液的反应 | ||
| C. | 乙烯生成聚乙烯 | D. | 苯和氢气反应生成环己烷 |
15.表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | Ka1=4.1×10-7Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时c(CH3COOH):c(CH3COO-)=9:5 | |
| C. | 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大 | |
| D. | 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后 |
12.下列关于碱金属元素的性质,说法不正确的是( )
| A. | 它们的原子核外电子层数随核电荷数的增加而增多,原子半径逐渐增大 | |
| B. | 从上到下,对应单质的颜色随着核电荷数的增加而加深 | |
| C. | 从上到下,随着核电荷数的增加,对应单质与水反应的剧烈程度逐渐增大 | |
| D. | 从上到下,随着核电荷数的增加,对应单质的熔、沸点都逐渐减小 |
19.某主族元素R的最高正化合价与最低负化合价代数和为4,下列叙述正确的是( )
| A. | R一定是氧元素 | B. | R的最高价氧化物为RO2 | ||
| C. | R的气态氢化物很稳定 | D. | R可以形成多种含氧酸 |
16.对于反应A2+3B2═2C来说,以下表示中,反应速率最快的是( )
| A. | v(B2)=0.8 mol•L-1•s-1 | B. | v(A2)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(B2)=1.8 mol•L-1•s-1 |
7.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法中正确的是( )
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |

 侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)
侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)