题目内容
17.工业上用菱锰矿(MnCO3)为原料制取二氧化锰,其流程示意图如图: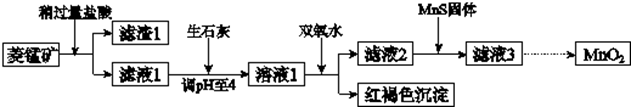
已知:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
(1)滤渣1为SiO2;
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS;在CuS、MnS共存的悬浊液中,则$\frac{c(C{u}^{2+})}{c(M{n}^{2+})}$=5.2×10-24.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□4H2O═□Cl2↑+□5MnO2+□8H+;
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+;
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2,检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
分析 菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入生石灰,调节溶液pH=4,加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液2中加入MnS,将溶液中Cu2+氧化为CuS沉淀过滤除去,滤液3中为MnCl2,系列转化得到MnO2.
(1)将菱锰矿粉碎,可以增大接触面积,提高反应速率;碳酸镁与盐酸反应生成氯化镁、二氧化碳与水;
(2)加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,根据电荷守恒有氢离子生成;
(3)MnS与氯化铜反应转化更难溶的CuS,同时得到氯化镁,在CuS、MnS共存的悬浊液中MnS+Cu2+=Mn2++CuS,K=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$×$\frac{c({S}^{2-})}{c({S}^{2-})}$=$\frac{Ksp(MnS)}{Ksp(CuS)}$;
(4)用酸化的NaClO3溶液将MnCl2氧化得到MnO2,Mn元素发生氧化反应,则Cl元素发生还原反应生成Cl2,由于在酸性条件下反应,根据电荷守恒可知,生成物中有H+生成,根据H元素守恒,可知反应物中缺项物质为H2O,结合电荷守恒、原子守恒配平;
(5)①由题意可知,Mn2+转化为MnO2,发生氧化反应,由O元素守恒可知有水参加反应,由电荷守恒可知应有H+生成;
②生成氯气发生氧化反应,在阳极产生,用润湿的淀粉碘化钾试纸检验.
解答 解:菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入生石灰,调节溶液pH=4,加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液2中加入MnS,将溶液中Cu2+氧化为CuS沉淀过滤除去,滤液3中为MnCl2,系列转化得到MnO2.
(1)菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,故答案为:SiO2;
(2)加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,根据电荷守恒有氢离子生成,反应离子方程式为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+,
故答案为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)MnS与氯化铜反应转化更难溶的CuS,同时得到氯化镁,反应离子方程式为:MnS+Cu2+=Mn2++CuS,在CuS、MnS共存的悬浊液中MnS+Cu2+=Mn2++CuS,K=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$×$\frac{c({S}^{2-})}{c({S}^{2-})}$=$\frac{Ksp(MnS)}{Ksp(CuS)}$,则$\frac{c(C{u}^{2+})}{c(M{n}^{2+})}$=$\frac{Ksp(CuS)}{Ksp(MnS)}$=$\frac{1.3×1{0}^{-36}}{2.5×1{0}^{-13}}$=5.2×10-24,
故答案为:MnS+Cu2+=Mn2++CuS;5.2×10-24;
(4)用酸化的NaClO3溶液将MnCl2氧化得到MnO2,Mn元素发生氧化反应,则Cl元素发生还原反应生成Cl2,由于在酸性条件下反应,根据电荷守恒可知,生成物中有H+生成,根据H元素守恒,可知反应物中缺项物质为H2O,配平后离子方程式为5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+,
故答案为:4H2O;Cl2↑;5MnO2;8H+;
(5)①由题意可知,Mn2+转化为MnO2,发生氧化反应,由O元素守恒可知有水参加反应,由电荷守恒可知应有H+生成,电极反应式为:Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
②生成氯气发生氧化反应,在阳极产生,检验Cl2的操作是:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成,
故答案为:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
点评 本题物质制备实验,主要是物质分离提纯、物质性质、溶度积常数计算、电解池原理的理解应用等,明确原理是解题关键,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

| A. | 凡吸热反应均需在加热条件下才能发生 | |
| B. | 离子化合物中不可能含有共价键 | |
| C. | 液氨作为清洁能源的反应原理是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | |
| D. | 实验收集NO和乙烯常用排水法不能用排空气法 |
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 在铁片上镀铜时,Y是纯铜 | |
| D. | 外加电流的阴极保护法中,Y是待保护金属 |
| A. | A、C两种元素仅可组成化学式为CA3的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是E>F>C>D | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
 .
.