题目内容
12.下列关于碱金属元素的性质,说法不正确的是( )| A. | 它们的原子核外电子层数随核电荷数的增加而增多,原子半径逐渐增大 | |
| B. | 从上到下,对应单质的颜色随着核电荷数的增加而加深 | |
| C. | 从上到下,随着核电荷数的增加,对应单质与水反应的剧烈程度逐渐增大 | |
| D. | 从上到下,随着核电荷数的增加,对应单质的熔、沸点都逐渐减小 |
分析 A.电子层越多,原子半径越大;
B.碱金属颜色除了铯略带金色,其余都是银白色;
C.依据同主族元素从上到下,金属性依次增加解答;
D.根据影响金属晶体熔沸点高低的因素判断.
解答 解:A.碱金属从上到下,电子层依次增大,则原子半径依次增大,故A正确;
B.碱金属颜色除了铯略带金色,其余都是银白色,不存在递变规律,故B错误;
C.同主族元素从上到下,金属性依次增加,单质与水反应剧烈程度依次增强,故C正确;
D.原子半径Li<Na<K<Rb<Cs,晶体结构相似,则原子半径越大,金属键越弱,单质的熔沸点越低,故D正确;
故选:B.
点评 本题考查了碱金属的性质,熟悉同主族元素性质的递变规律是解题关键,注意金属晶体熔沸点影响因素,题目难度中等.

练习册系列答案
相关题目
3.在150℃时,某气态混合烃和过量O2在一密闭容器中完全反应,测知反应前后压强没有变化,则该混合烃可能是( )
| A. | CH4和C2H4 | B. | CH4和C2H6 | C. | C2H4和C2H6 | D. | C3H4和C3H6 |
20.已知HCN是直线型结构,下列有机分子中,所有的原子不可能处于同一平面的是( )
| A. | CH2═CH-CN | B. | CH2═CH-CH═CH2 | C. |  | D. |  |
7.六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
| A. | A、C两种元素仅可组成化学式为CA3的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是E>F>C>D | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
17.下列各项中表达正确的是考( )
| A. | CO2的电子式为: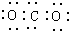 | B. | Cl2的结构式: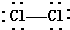 | ||
| C. | 用电子式表示NaCl的形成过程: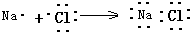 | D. | F-的结构示意图: |
4.下列实验现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将20mL2mol/L的NaOH溶液缓缓地倒入20mL2mol/L的盐酸中,边加边搅拌,测定反应前后溶液温度的变化 | 温度升高 | 释放出的热量就是中和热 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小段镁带和一小块铝分别放在同体积、同浓度的盐酸中 | 都有气泡产生,镁带产生气泡更快 | 镁比铝活泼 |
| D | 将少量氯气通入到NaBr溶液中 | 溶液变成橙红色 | 氯气溶于水呈现橙红色 |
| A. | A | B. | B | C. | C□D.D |
1.下列说法正确的是( )
| A. | 氯气不可用于自来水的消毒 | B. | 镁可用于制造信号弹和焰火 | ||
| C. | 氢氧化铁胶体不能用于净水 | D. | 二氧化硫不可用于漂白纸浆 |
12.在25℃时,浓度均为1mol/L的醋酸钠(CH3COONa)、碳酸钠(Na2CO3)、苯酚钠(C6H5ONa)的溶液,测得其pH值分别为a、b、c,下列判断正确的是( )
| A. | a=b=c | B. | a>b>c | C. | b>c>a | D. | c>b>a |
 .
.