题目内容
能正确表示下列反应的离子方程式的是( )
| A、将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ | ||||
| B、石灰石与醋酸溶液反应:CaCO3+2H+=Ca2++H2O+CO2↑ | ||||
| C、溴化亚铁溶液中通入少量氯气:2Br-+Cl2=Br2+2C1- | ||||
D、NH4HCO3溶液中加入足量的NaOH溶液:NH+4+OH-
|
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成氯化亚铁和氯化铜;
B.醋酸在离子反应中保留化学式;
C.少量氯气,先氧化亚铁离子;
D.漏写碳酸氢根离子与碱的反应.
B.醋酸在离子反应中保留化学式;
C.少量氯气,先氧化亚铁离子;
D.漏写碳酸氢根离子与碱的反应.
解答:
解:A.将铜屑加入Fe3+溶液中的离子反应为2Fe3++Cu=2Fe2++Cu2+,故A正确;
B.石灰石与醋酸溶液反应的离子反应为CaCO3+2HAc=Ca2++H2O+CO2↑+2Ac-,故B错误;
C.溴化亚铁溶液中通入少量氯气的离子反应为2Fe2++Cl2=2Fe3++2C1-,故C错误;
D.NH4HCO3溶液中加入足量的NaOH溶液的离子反应为HCO3-+NH4++2OH-
NH3↑+2H2O+CO32-,故D错误;
故选A.
B.石灰石与醋酸溶液反应的离子反应为CaCO3+2HAc=Ca2++H2O+CO2↑+2Ac-,故B错误;
C.溴化亚铁溶液中通入少量氯气的离子反应为2Fe2++Cl2=2Fe3++2C1-,故C错误;
D.NH4HCO3溶液中加入足量的NaOH溶液的离子反应为HCO3-+NH4++2OH-
| ||
故选A.
点评:本题考查离子反应的书写,为高频考点,把握发生的化学反应为解答的关键,注意离子反应的应保留化学式的物质及反应中量对反应的影响,题目难度不大.

练习册系列答案
相关题目
下列各表述与示意图不一致的是( )


| A、图①表示一个可逆反应达到平衡状态后又可能使用了催化剂 |
| B、图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0,正、逆反应的平衡常数K随温度的变化 |
| C、对反应aA(g)+bB(g)?cC(g)来说,图③x点表示在相应的压强条件下该反应正在向正反应方向进行 |
| D、图④中a、b曲线分别表示反应CH2=CH2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH-
2CO32-+6H2O,则下列说法中错误的是( )
| 放电 |
| 充电 |
| A、放电时CH3OH参与反应的电极为负极 |
| B、充电时电解质溶液的pH逐渐减小 |
| C、放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、充电时每生成1mol CH3OH转移6 mol电子 |
 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述正确的是( )| A、b极发生氧化反应 |
| B、a极的反应式:N2H4+4OH--4e-=N2↑+4H2O |
| C、放电时,电流从a极经过负载流向b极 |
| D、其中的离子交换膜需选用阳离子交换膜 |
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合溶液中:c(Na+)=c(CH3COO-) |
| B、相同条件下pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸溶液中由水电离的c(H+):①>②>③ |
| C、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序:①=②>③ |
| D、0.1mol/L醋酸钡溶液中,c (Ba2+)>c(CH3COO-)>c(OH-)>c (H+) |
聚丙烯酸钠(单体为:CH2=CHCOONa) 是一种高性能吸水树脂,可在干旱地区用于农业、林业、植树造林时的抗旱保水.下列关于聚丙烯酸钠的说法正确是( )
A、聚丙烯酸钠的结构式为 |
| B、聚丙烯酸钠可以通过单体发生缩聚反应制得 |
| C、聚丙烯酸钠具有热塑性 |
| D、聚丙烯酸钠是一种体型结构的高分子材料 |
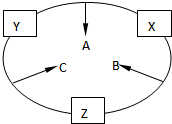 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.