题目内容
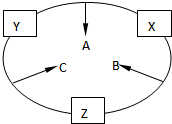 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.请回答下列问题:
(1)元素X位于
(2)元素Y的原子结构示意图
(3)用电子式表示B的形成过程:
(4)B与C的稳定性大小顺序为
(5)C与X在一定条件下生成化合物A的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,则这三种气体是氮气、氧气和氢气(稀有气体除外),生成的三种化合物有NO、H2O、NH3,B分子组成中Z原子个数比C分子中少一个,比较这三种分子知,只有水分子中的H原子比氨气分子中的氢原子少一个,所以Z为H元素,A分子为NO,B分子为H2O,C分子为NH3,所以Y是N元素,X为O元素,结合物质的结构性质解答.
解答:
解:原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,则这三种气体是氮气、氧气和氢气(稀有气体除外),生成的三种化合物有NO、H2O、NH3,B分子组成中Z原子个数比C分子中少一个,比较这三种分子知,只有水分子中的H原子比氨气分子中的氢原子少一个,所以Z为H元素,A分子为NO,B分子为H2O,C分子为NH3,所以Y是N元素,X为O元素,
(1)X为O元素,氧原子核外有2个电子层,最外层电子数是6,所以O元素位于第二周期ⅥA族,
故答案为:第二周期ⅥA族;
(2)Y是N原子,氮原子核外有2个电子层,最外层有5个电子,所以其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)两个氢原子和氧原子共用电子对而形成共价键,其形成过程为: ,
,
故答案为: ;
;
(4)元素的非金属性越强,其氢化物的稳定性越强,同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以稳定性H2O>NH3,故答案为:H2O>NH3;
(5)X为氧气,C为氨气,在催化剂、加热条件下,氨气和氧气反应生成一氧化氮和水,反应方程式为:
4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O.
(1)X为O元素,氧原子核外有2个电子层,最外层电子数是6,所以O元素位于第二周期ⅥA族,
故答案为:第二周期ⅥA族;
(2)Y是N原子,氮原子核外有2个电子层,最外层有5个电子,所以其原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(3)两个氢原子和氧原子共用电子对而形成共价键,其形成过程为:
 ,
,故答案为:
 ;
;(4)元素的非金属性越强,其氢化物的稳定性越强,同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以稳定性H2O>NH3,故答案为:H2O>NH3;
(5)X为氧气,C为氨气,在催化剂、加热条件下,氨气和氧气反应生成一氧化氮和水,反应方程式为:
4NH3+5O2
| ||
| △ |
| ||
| △ |
点评:本题考查了元素、物质的推断,以“B分子组成中Z原子个数比C分子中少一个”为题眼进行推断,结合物质的化学式来分析解答,题目难度中等.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式的是( )
| A、将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ | ||||
| B、石灰石与醋酸溶液反应:CaCO3+2H+=Ca2++H2O+CO2↑ | ||||
| C、溴化亚铁溶液中通入少量氯气:2Br-+Cl2=Br2+2C1- | ||||
D、NH4HCO3溶液中加入足量的NaOH溶液:NH+4+OH-
|
氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20.某硫酸铜溶液中c(Cu2+)=0.02mol/L,若要生成Cu(OH)2沉淀,应调整溶液pH使之大于( )
| A、3 | B、5 | C、7 | D、9 |
下列离子方程式中,正确的( )
| A、向AlCl3溶液中逐渐滴入NaOH溶液至过量:Al3++4OH-=AlO2-+2H2O |
| B、将碳酸钙加入过量盐酸中:CO32-+2H+=CO2↑+H2O |
| C、向氯化铁溶液中加入铁粉:2Fe3++Fe=3Fe2+ |
| D、在CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
常温下,下列各组离子可能大量共存的是( )
| A、pH=7的溶液:Fe3+、NH4+、Cl-、NO3- |
| B、pH=2的溶液:Fe2+、Al3+、Cl-、NO3- |
| C、能使甲基橙显黄色的溶液:Cl-、CO32-、K+、AlO2- |
| D、与铝反应产生大量氢气的溶液:[Ag(NH3)2]+、Na+、CH3COO-、NH4+ |



 .
.