题目内容
17.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )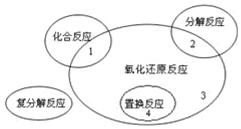
| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
分析 由图可知,区域3为氧化还原反应,但不属于置换反应,含元素化合价变化的反应为氧化还原反应,以此来解答.
解答 解:A.为复分解反应,故A不选;
B.为置换反应,故B不选;
C.为分解反应,故C不选;
D.C、Fe元素的化合价变化,为氧化还原反应,且不属于置换反应,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、区域3中的反应类型为解答的关键,侧重分析与应用能力的考查,注意基本反应类型的判断,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
12.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,在等体积、等浓度的硝酸中加入氨水,溶液的导电性增强 | |
| C. | 25℃时,0.1mol/L的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 | |
| D. | 25℃时,将等体积PH=1的盐酸和水混合,混合后溶液的PH=1.3 |
2.如图是金属牺牲阳极的阴极保护法的实验装置,有关说法正确的是( )
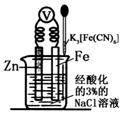

| A. | 该装置为电解池 | |
| B. | 本实验牺牲了金属Fe来保护金属Zn | |
| C. | 若加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀 | |
| D. | 远洋货轮上镶嵌的金属Zn长时间没有什么变化,不需要更换 |
9.金属单质具有的通性是( )
| A. | 硬度大 | |
| B. | 熔、沸点较低 | |
| C. | 质软 | |
| D. | 具有金属光泽、导电、导热、有延展性 |
6.T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的物质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分含量与时间的关系如图-2所示.下列分析正确的是( )
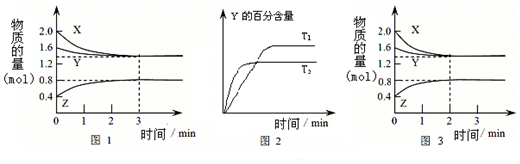

| A. | 容器中发生的反应可表示为:2X(g)+Y(g)?2Z(g) | |
| B. | 0~3 min内,v(X)=0.2 mol•L-1•min-1 | |
| C. | 其他条件不变升高温度,v正、v逆都增大,且重新平衡前v正>v逆 | |
| D. | 若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
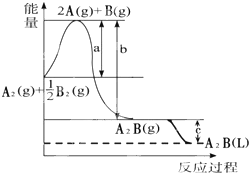 已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反应过程中能量变化如图,问:
已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反应过程中能量变化如图,问:
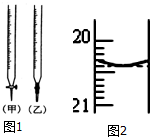 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题: