题目内容
20.在下列条件下,两种气体的分子数一定相等的是( )①同质量、不同密度的N2和C2H4 ②同温度、同体积的O2和N2
③不同温度压强下、同物质的量的CO2和C2H4 ④同压强、同体积的N2和O2.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
分析 结合n=$\frac{m}{M}$、n=$\frac{V}{Vm}$及N=nNA可知,气体的物质的量相同,则分子数相同,以此来解答.
解答 解:①二者M相同,质量相同,由m=nM可知,二者物质的量相同,则分子数相同,故选;
②同温度、同体积,压强未知,不能确定Vm,则不能确定物质的量及分子数关系,故不选;
③同物质的量,则同分子数,故选;
④同压强、同体积,温度未知,不能确定Vm,则不能确定物质的量及分子数关系,故不选;
故选C.
点评 本题考查阿伏伽德罗定律及应用,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意气体的体积受温度、压强影响,题目难度不大.

练习册系列答案
相关题目
10.用0.1mol/L的硫酸溶液滴定未知浓度的NaOH溶液,导致测定的NaOH浓度值偏大的操作有( )
| A. | 将待测液NaOH溶液取到锥形瓶后,露置空气中较长时间,以酚酞为指示剂测定 | |
| B. | 以甲基橙为指示剂,当甲基橙变红时停止滴定 | |
| C. | 移液管用蒸馏水冲洗后直接移取待测液 | |
| D. | 滴定终点读数时俯视 |
15.鉴别下列物质,只能用焰色反应的是( )
| A. | K2CO3和KCl | B. | NaCl和Na2CO3 | C. | NaCl和MgCl2 | D. | NaCl和KCl |
12.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,在等体积、等浓度的硝酸中加入氨水,溶液的导电性增强 | |
| C. | 25℃时,0.1mol/L的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 | |
| D. | 25℃时,将等体积PH=1的盐酸和水混合,混合后溶液的PH=1.3 |
9.金属单质具有的通性是( )
| A. | 硬度大 | |
| B. | 熔、沸点较低 | |
| C. | 质软 | |
| D. | 具有金属光泽、导电、导热、有延展性 |
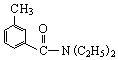 ; DEET在一定条件下,可通过下面的路线来合成:
; DEET在一定条件下,可通过下面的路线来合成: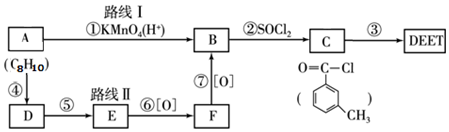
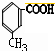 .
.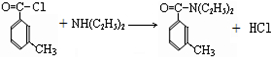 .
.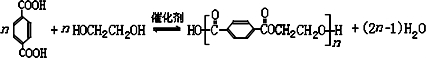 .
.
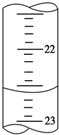 某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:
某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下: