题目内容
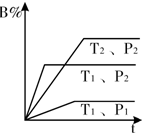 已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )
已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )| A、T1<T2 P1>P2 m+n>p Q<0 |
| B、T1>T2 P1<P2 m+n>p Q<0 |
| C、T1<T2 P1>P2 m+n<p Q>0 |
| D、T1>T2 P1<P2 m+n<p Q>0 |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:温度相同时,根据到达平衡的时间判断压强大小,再根据压强对B的含量的影响,判断压强对平衡的影响,确定反应气体气体体积变化情况;
压强相同时,根据到达平衡的时间判断温度大小,再根据温度对B的含量的影响,判断温度对平衡的影响,确定反应的热效应.
压强相同时,根据到达平衡的时间判断温度大小,再根据温度对B的含量的影响,判断温度对平衡的影响,确定反应的热效应.
解答:
解:由图象可知,温度为T1时,根据到达平衡的时间可知P2>P1,且压强越大,B的含量高,说明压强增大平衡向逆反应方向移动,故正反应为气体体积增大的反应,即m+n<p;
压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,B的含量低,说明温度升高平衡向正反应方向移动,则正反应为吸热反应,即△H=Q>0,
故选D.
压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,B的含量低,说明温度升高平衡向正反应方向移动,则正反应为吸热反应,即△H=Q>0,
故选D.
点评:本题考查化学平衡图象问题,难度不大,本题注意根据图象判断温度、压强的大小,根据温度、压强对平衡移动的影响分析.

练习册系列答案
相关题目
把200mL NH4HCO3和Na2CO3的混合溶液分成二等份,取一份加入含a mol氢氧化钠的溶液加热,恰好使NH4+完全转化为NH3逸出,另取一份加入含b molHCl的盐酸恰好反应完全生成CO2,则该混合溶液中c(Na+)为( )
A、(
| ||||
| B、(2b-a) mol/L | ||||
C、(5b-
| ||||
| D、(10b-5a) mol/L |
物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒关系错误是( )
| A、c (Na+)+c (H+)=c (X-)+c (OH-) |
| B、c (HX)+c (X-)=2 c (Na+) |
| C、若溶液显酸性,则有:c (X-)>c (Na+)>c (HX)>c (H+)>c (OH-) |
| D、若溶液显碱性,则有:c (Na+)>c (HX)>c (X-)>c (OH-)>c (H+) |
某同学在实验室中用KClO3代替MnO2制备Cl2,反应原理为KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.下列叙述不正确的是( )
| A、氧化剂为KClO3,其中Cl元素被还原 |
| B、若有3molH2O生成,则反应中有6mol电子转移 |
| C、浓HCl在反应中起酸性和还原性的作用 |
| D、氧化剂与还原剂的物质的量之比为1:5 |
下列描述中正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、中和反应都是放热反应 |
| C、放热反应的反应速率总是大于吸热反应的反应速率 |
| D、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连.则下列叙述不正确的是( )


| A、甲是化学能转变为电能,乙、丙是电能转变为化学能 |
| B、C1、C2分别是阳极、阴极,锌片、C3上都发生氧化反应 |
| C、C1和C3放出的气体相同,铜片和铁片放出的气体也相同 |
| D、甲中溶液的pH逐渐升高,乙、丙中溶液的pH逐渐减小 |
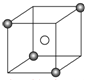 某离子晶体的晶胞结构如图所示,X(
某离子晶体的晶胞结构如图所示,X( )位于立方体的顶点,Y(○)位于立方体的中心.试分析:
)位于立方体的顶点,Y(○)位于立方体的中心.试分析: