题目内容
把200mL NH4HCO3和Na2CO3的混合溶液分成二等份,取一份加入含a mol氢氧化钠的溶液加热,恰好使NH4+完全转化为NH3逸出,另取一份加入含b molHCl的盐酸恰好反应完全生成CO2,则该混合溶液中c(Na+)为( )
A、(
| ||||
| B、(2b-a) mol/L | ||||
C、(5b-
| ||||
| D、(10b-5a) mol/L |
考点:化学方程式的有关计算
专题:
分析:100mL混合溶液加入含a mol氢氧化钠的溶液加热,恰好使NH4+完全转化为NH3逸出,反应关系式为:NH4HCO3~2NaOH,所以n(NH4HCO3)=
mol,而另100mL混合溶液加入含b mol HCl的盐酸的反应为:NH4HCO3+HCl═NH4Cl+CO2↑+H2O,可知碳酸氢铵消耗
mol的盐酸,则碳酸钠消耗(b-
)mol,由反应Na2CO3+2HCl═2NaCl+H2O+CO2↑,可知碳酸钠的物质的量,然后根据组成求混合物中钠离子的浓度.
| a |
| 2 |
| a |
| 2 |
| a |
| 2 |
解答:
解:100mL混合溶液加入含a mol氢氧化钠的溶液加热,恰好使NH4+完全转化为NH3逸出,反应关系式为:NH4HCO3~2NaOH,所以n(NH4HCO3)=
mol,而另100mL混合溶液加入含b mol HCl的盐酸的反应为:NH4HCO3+HCl═NH4Cl+CO2↑+H2O,可知碳酸氢铵消耗
mol的盐酸,则碳酸钠消耗(b-
)mol,由反应Na2CO3+2HCl═2NaCl+H2O+CO2↑,可知碳酸钠的物质的量为(b-
)mol÷2=(
-
)mol,故混合溶液中c(Na+)=
=(10b-5a) mol/L,
故选D.
| a |
| 2 |
| a |
| 2 |
| a |
| 2 |
| a |
| 2 |
| b |
| 2 |
| a |
| 4 |
(
| ||||
| 0.1 |
故选D.
点评:本题考查混合物的有关计算,难度不大,明确发生的化学反应,注意利用守恒思想进行的解答,侧重考查学生的思维能力、分析解决问题能力.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如图所示( )
)的废水可以利用微生物电池除去,其原理如图所示( )

 )的废水可以利用微生物电池除去,其原理如图所示( )
)的废水可以利用微生物电池除去,其原理如图所示( )
| A、B极是正极 |
| B、B极是阳极 |
| C、每转移2mol电子,有1molCH3COO-被氧化 |
D、A极电极反应式为: +2e-+H+ +2e-+H+ +Cl- +Cl- |
选出下列与浓硫酸的反应活性最高的烯烃( )
A、 |
B、 |
| C、═ |
食盐、纯碱、食醋均为厨房中常用的物质,利用这些物质不能实现的实验是( )
①除去热水瓶内壁的水垢
②检验自来水中是否含有氯离子
③检验镁粉中是否含有铝粉
④鉴别食盐和纯碱.
①除去热水瓶内壁的水垢
②检验自来水中是否含有氯离子
③检验镁粉中是否含有铝粉
④鉴别食盐和纯碱.
| A、①③ | B、②③ | C、②④ | D、①② |
金属钠应存放于①煤油 ②石蜡油 ③四氯化碳 ④密闭容器( )
| A、①②③ | B、②③④ |
| C、①②④ | D、①②③④ |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A、氯气通入氢氧化钠溶液中:[Na+]=[Cl-]+[ClO-]+[OH-] |
| B、pH=8.3的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] |
| C、pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] |
| D、某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:[NH4+]>[SO42-]>[H+]>[OH-] |
下列物质中,不能通过化合反应直接生成的是( )
| A、FeS |
| B、Fe(OH)3 |
| C、FeCl2 |
| D、Al(OH)3 |
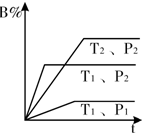 已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )
已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )| A、T1<T2 P1>P2 m+n>p Q<0 |
| B、T1>T2 P1<P2 m+n>p Q<0 |
| C、T1<T2 P1>P2 m+n<p Q>0 |
| D、T1>T2 P1<P2 m+n<p Q>0 |