题目内容
某同学在实验室中用KClO3代替MnO2制备Cl2,反应原理为KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.下列叙述不正确的是( )
| A、氧化剂为KClO3,其中Cl元素被还原 |
| B、若有3molH2O生成,则反应中有6mol电子转移 |
| C、浓HCl在反应中起酸性和还原性的作用 |
| D、氧化剂与还原剂的物质的量之比为1:5 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:由KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O可知,氯酸钾中Cl元素化合价由+5价变为0价、HCl中Cl元素化合价由-1价变为0价,所以氯酸钾是氧化剂、部分氯化氢是还原剂,以此来解答.
解答:
解:A.氯酸钾中Cl元素化合价由+5价变为0价,作氧化剂,得到电子被还原,故A正确;
B.由反应可知,生成3molH2O,只有1molKClO3反应,转移电子为5mol,故B错误;
C.由反应可知,6molHCl中,5mol作还原剂,1mol为酸,故C正确;
D.1molKClO3与5molHCl转移电子相等,则氧化剂与还原剂的物质的量之比为1:5,故D正确;
故选B.
B.由反应可知,生成3molH2O,只有1molKClO3反应,转移电子为5mol,故B错误;
C.由反应可知,6molHCl中,5mol作还原剂,1mol为酸,故C正确;
D.1molKClO3与5molHCl转移电子相等,则氧化剂与还原剂的物质的量之比为1:5,故D正确;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
金属钠应存放于①煤油 ②石蜡油 ③四氯化碳 ④密闭容器( )
| A、①②③ | B、②③④ |
| C、①②④ | D、①②③④ |
下列关于“焰色反应”的理解正确的是( )
| A、只有金属离子才有焰色反应 |
| B、某物质灼烧时焰色反应为黄色,则一定只含钠元素,不含其他元素 |
| C、做焰色反应实验时最好选择本身颜色较浅的火焰 |
| D、每次实验后,要将铂丝用稀硫酸洗净 |
相同温度时,下列溶液中导电能力最强的是( )
| A、50mL 1.5mol/L 蔗糖溶液 |
| B、100mL 1.0mol/L 醋酸溶液 |
| C、50mL 0.5mol/L AlCl3溶液 |
| D、100mL 0.5mol/L MgCl2溶液 |
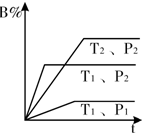 已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )
已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )| A、T1<T2 P1>P2 m+n>p Q<0 |
| B、T1>T2 P1<P2 m+n>p Q<0 |
| C、T1<T2 P1>P2 m+n<p Q>0 |
| D、T1>T2 P1<P2 m+n<p Q>0 |
将2.0g铜镁合金完全溶于浓HNO3,若反应中硝酸被还原后只产生1.12LNO2气体和168mL N2O4气体(均已折算成标准状况下),在反应后的溶液中,加入足量的氢氧化钠溶液,产生沉淀的质量为( )
| A、3.165g |
| B、3.105g |
| C、4.255g |
| D、5.625g |
氧化还原反应广泛地存在于生产和生活之中.下列过程中不涉及氧化还原反应的是( )
| A、金属的冶炼 | B、燃放鞭炮 |
| C、食物的腐败 | D、豆浆制豆腐 |
下列说法正确的是( )
| A、1molCO2在20℃是的体积大于22.4L |
| B、1molCO2和1molCO的体积相同 |
| C、1molCO2与38gCO所含分子数相同 |
| D、1molCO2在标准状况下的体积约为22.4L |