题目内容
物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒关系错误是( )
| A、c (Na+)+c (H+)=c (X-)+c (OH-) |
| B、c (HX)+c (X-)=2 c (Na+) |
| C、若溶液显酸性,则有:c (X-)>c (Na+)>c (HX)>c (H+)>c (OH-) |
| D、若溶液显碱性,则有:c (Na+)>c (HX)>c (X-)>c (OH-)>c (H+) |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡
专题:
分析:A.溶液中一定满足电荷守恒,根据电荷守恒判断;
B.根据混合液中的物料守恒分析;
C.溶液显示酸性,则说明HX的电离程度大于NaX的水解程度,结合物料守恒可得:c(X-)>c(Na+)>c(HX);
D.溶液显示碱性,说明HX的电离程度小于NaX的水解程度,则c (HX)>c(Na+)>c (X-).
B.根据混合液中的物料守恒分析;
C.溶液显示酸性,则说明HX的电离程度大于NaX的水解程度,结合物料守恒可得:c(X-)>c(Na+)>c(HX);
D.溶液显示碱性,说明HX的电离程度小于NaX的水解程度,则c (HX)>c(Na+)>c (X-).
解答:
解:A.根据混合液中的电荷守恒可得:c(Na+)+c(H+)=c(X-)+c(OH-),故A正确;
B.根据混合液中的物料守恒可得:c(HX)+c(X-)=2c (Na+),故B正确;
C.若溶液显酸性,说明HX的电离程度大于NaX的水解程度,则:c (H+)>c (OH-)、c (X-)>c (HX),结合物料守恒可得:c(X-)>c(Na+)>c(HX),溶液中离子浓度大小为:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故C正确;
D.液显碱性,说明HX的电离程度小于NaX的水解程度,c (H+)<c (OH-)、c (X-)<c (HX),结合物料守恒可得:c (HX)>c(Na+)>c (X-),则溶液中离子浓度大小为:c (HX)>c (Na+)>c (X-)>c (OH-)>c (H+),故D错误;
故选D.
B.根据混合液中的物料守恒可得:c(HX)+c(X-)=2c (Na+),故B正确;
C.若溶液显酸性,说明HX的电离程度大于NaX的水解程度,则:c (H+)>c (OH-)、c (X-)>c (HX),结合物料守恒可得:c(X-)>c(Na+)>c(HX),溶液中离子浓度大小为:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故C正确;
D.液显碱性,说明HX的电离程度小于NaX的水解程度,c (H+)<c (OH-)、c (X-)<c (HX),结合物料守恒可得:c (HX)>c(Na+)>c (X-),则溶液中离子浓度大小为:c (HX)>c (Na+)>c (X-)>c (OH-)>c (H+),故D错误;
故选D.
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,注意明确电荷守恒、物料守恒、质子守恒的含义,明确盐的水解原理及其应用方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
食盐、纯碱、食醋均为厨房中常用的物质,利用这些物质不能实现的实验是( )
①除去热水瓶内壁的水垢
②检验自来水中是否含有氯离子
③检验镁粉中是否含有铝粉
④鉴别食盐和纯碱.
①除去热水瓶内壁的水垢
②检验自来水中是否含有氯离子
③检验镁粉中是否含有铝粉
④鉴别食盐和纯碱.
| A、①③ | B、②③ | C、②④ | D、①② |
下列物质中,不能通过化合反应直接生成的是( )
| A、FeS |
| B、Fe(OH)3 |
| C、FeCl2 |
| D、Al(OH)3 |
下列关于“焰色反应”的理解正确的是( )
| A、只有金属离子才有焰色反应 |
| B、某物质灼烧时焰色反应为黄色,则一定只含钠元素,不含其他元素 |
| C、做焰色反应实验时最好选择本身颜色较浅的火焰 |
| D、每次实验后,要将铂丝用稀硫酸洗净 |
相同温度时,下列溶液中导电能力最强的是( )
| A、50mL 1.5mol/L 蔗糖溶液 |
| B、100mL 1.0mol/L 醋酸溶液 |
| C、50mL 0.5mol/L AlCl3溶液 |
| D、100mL 0.5mol/L MgCl2溶液 |
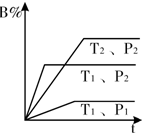 已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )
已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )| A、T1<T2 P1>P2 m+n>p Q<0 |
| B、T1>T2 P1<P2 m+n>p Q<0 |
| C、T1<T2 P1>P2 m+n<p Q>0 |
| D、T1>T2 P1<P2 m+n<p Q>0 |
氧化还原反应广泛地存在于生产和生活之中.下列过程中不涉及氧化还原反应的是( )
| A、金属的冶炼 | B、燃放鞭炮 |
| C、食物的腐败 | D、豆浆制豆腐 |