题目内容
9.下列说法正确的是( )| A. | 12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| B. | 合成纤维是利用自然界的纤维材料通过化学合成方法得到的 | |
| C. | 研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果 | |
| D. | 碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响 |
分析 A.氢气燃烧放出大量的热量,且燃烧产物是水没有污染,水可以在光能作用下分解成氧气和氢气;
B.合成纤维是将人工合成的、具有适宜分子量并具有可溶(或可熔)性的线型聚合物;
C.催化剂不能使平衡移动;
D.过渡状态理论认为:反应物分子并不只是通过简单碰撞直接形成产物,而是必须经过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要的一定的活化能.
解答 解:A.12C、13C和14C质子数同为6,而中子数分别为6、7、8,互为同位素,只有14C的放射性可用于考古断代,故A错误;
B.合成纤维是将人工合成的、具有适宜分子量并具有可溶(或可熔)性的线型聚合物,经纺丝成形和后处理而制得的化学纤维,故B错误;
C.催化剂不能使平衡移动,只能改变反应速率,故C正确;
D.过渡态理论不可解释温度对反应速率的影响,故D错误.
故选C.
点评 本题考查较为综合,涉及同位素、合成纤维、催化剂以及碰撞理论等知识,为高频考点,侧重于化学与生活、环境的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
19. 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.
(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
依照表中操作,该同学进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
为了进一步探究溶液变成深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
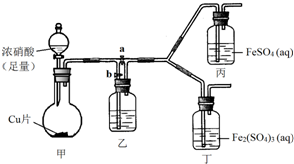
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO)3+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO${\;}_{3}^{-}$+2H+=Fe3++NO2↑+H2O |
为了进一步探究溶液变成深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者(加了数滴浓硝酸的FeSO4溶液)变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的.为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后(溶质不变),使甲中反应继续,观察到的现象与步骤ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO)3+2NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到).
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
17.对下列物质用途的描述不符合事实的是( )
| A. | 硅酸钠可用作木材防火涂料 | B. | Fe2O3可用作外墙涂料 | ||
| C. | 过氧化钠可用作潜艇供氧剂 | D. | 铝制容器可以贮运稀硝酸 |
1.一种气态烷烃与一种气态炔烃等体积混合,测得混合气体在标准状况下的密度为1.25g/L,则构成这种混合气体的烷烃和炔烃可能是( )
| A. | 甲烷,丙炔 | B. | 甲烷,丁炔 | C. | 乙烷,乙炔 | D. | 乙烷,丙炔 |
7.下列推理正确的是( )
| A. | 铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O | |
| B. | 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 | |
| C. | 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 | |
| D. | 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂 |
 c.
c.
 .
.