题目内容
2.实验室里由粗盐制备精盐的实验中,必需的操作步骤有( )| A. | 分液 | B. | 过滤 | C. | 溶解 | D. | 蒸发结晶 |
分析 实验室里由粗盐制备精盐的实验中,首先将粗盐溶解,然后加入除杂试剂将杂质离子变成沉淀,然后通过过滤除去难溶物,最后对滤液进行蒸发浓缩达到纯净的氯化钠,以此解答该题.
解答 解:粗盐提纯过程为:溶解粗盐(C选项),加入试剂将杂质离子除去,接着过滤除去难溶物、泥沙等(B选项),加入盐酸调节溶液pH,除去过量的除杂试剂,最后通过蒸发浓缩达到纯净的氯化钠(D选项),所以必需的操作为:溶解、过滤、蒸发浓缩,不需要分液,
故选BCD.
点评 本题考查了粗盐的提纯方法,题目难度不大,注意掌握粗盐提纯过程中除杂试剂的选用及除杂试剂的加入顺序,明确除杂原则.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
12.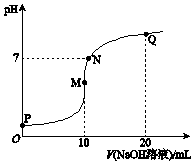 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )
 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )| A. | P点pH较低的主要原因是NH4+水解 | |
| B. | P、M、N、Q四点中,水的电离程度较大的是N点 | |
| C. | M点 c(Na+)>c(NH4+); N点 c(NH4+)+c(Na+)═2c(SO42-) | |
| D. | Q点 c(NH4+)+c(NH3•H2O)═c(Na+) |
13.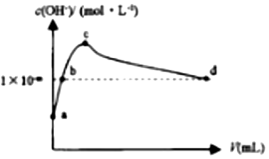 常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
 常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-mmol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) |
10.某烃中碳和氢的质量比是24:5,该烃在标准状况下的密度是2.59g/L,其分子式为( )
| A. | C2H6 | B. | C4H10 | C. | C5H12 | D. | C4H8 |
17.某元素R的最高价氧化物的水化物分子式是H3RO4,则在气态氢化物中R元素的化合价是( )
| A. | -1 | B. | -2 | C. | -3 | D. | -4 |
7.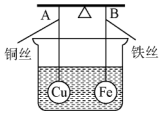 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A端高B端低 | |
| B. | 杠杆为导体和绝缘体时,均为A端低B端高 | |
| C. | 当标杆为绝缘体时,A端低B端高;为导体时,A端高B端低 | |
| D. | 当标杆为绝缘体时,A端高B端低;为导体时,A端低B端高 |
11.在相同的条件下,一定量的氢气在氧气中充分燃烧并放出热量.若生成液态水放出的热量为Q1;若生成气态水放出的热量为Q2.那么Q1与Q2之间的关系是( )
| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法确定 |
1.称取(NH4)2SO4和NH4HSO4混合物样品7.24g,加入含0.1mol NaOH的溶液,完全反应后加热,生成NH3 1792mL(标准状况),则下列说法正确的是( )
| A. | NaOH只与NH4HSO4反应 | |
| B. | (NH4)2SO4在水中的电离方程式:(NH4)2SO4=NH4++SO42- | |
| C. | NH4HSO4的物质的量是0.04 mol | |
| D. | (NH4)2SO4和NH4HSO4物质的量之比是1.87:1 |
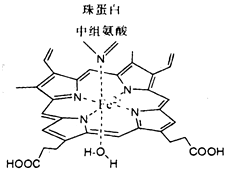 红细胞中血红素结构如图所示,回答下列问题:
红细胞中血红素结构如图所示,回答下列问题: .
.