题目内容
12.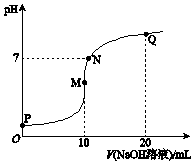 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )| A. | P点pH较低的主要原因是NH4+水解 | |
| B. | P、M、N、Q四点中,水的电离程度较大的是N点 | |
| C. | M点 c(Na+)>c(NH4+); N点 c(NH4+)+c(Na+)═2c(SO42-) | |
| D. | Q点 c(NH4+)+c(NH3•H2O)═c(Na+) |
分析 A.P点为硫酸氢铵溶液,硫酸氢铵为强电解质,在溶液中完全电离出氢离子、铵根离子和硫酸根离子,溶液呈酸性;
B.M点溶质为硫酸铵和硫酸钠,铵根离子水解促进了水的电离,而Q溶质为硫酸钠和一水合氨,溶液呈碱性,氨水中氢氧根离子抑制了水的电离;
C.M点溶质为等浓度的硫酸钠和硫酸铵,铵根离子部分水解;N点溶液呈中性,c(H+)=c(OH-),结合电荷守恒判断;
D.Q点溶质为等浓度的硫酸钠和一水合氨,结合物料守恒判断.
解答 解:A.P点氢氧化钠溶液体积为0,此时为NH4HSO4溶液,NH4HSO4为强电解质,在溶液中完全电离:NH4HSO4=NH4++H++SO42- (或 HSO4-=H++SO42-),溶液呈酸性,所以此时溶液的pH<7,主要原因不是铵根离子的水解,故A错误;
B.根据图示可知,P点呈强酸性,抑制了水的电离;M点加入10mLNaOH溶液,此时二者恰好反应生成硫酸钠和硫酸铵,铵根离子发生水解,促进了水的电离;N点为中性,不影响水的电离;Q点加入20mLNaOH溶液,此时溶质为硫酸钠和NH3•H2O,氨水电离出的氢氧根离子抑制了水的电离;所以水的电离程度较大的为M点,故B错误;
C.M点溶质为等浓度的硫酸钠和硫酸铵,由于铵根离子部分水解,导致铵根离子浓度减小,则c(Na+)>c(NH4+);N点溶液呈中性,则c(H+)=c(OH-),结合电荷守恒可知:c(NH4+)+c(Na+)=2c(SO42-),故C正确;
D.Q点溶质为等浓度的硫酸钠和一水合氨,结合物料守恒可知:2c(NH4+)+2c(NH3•H2O)=c(Na+),故D错误;
故选C.
点评 本题考查溶液酸碱性与溶液pH的关系、离子浓度大小比较,题目难度中等,明确图象曲线各点对应溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理的含义及应用,试题培养了学生的分析、理解能力及灵活应用能力.


| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| C. | 若开始时开关K与b连接,则该装置是化学能转变为电能 | |
| D. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 |
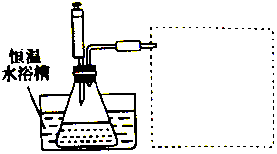 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:| 实验序号 | 参加反应的物质 | 收集amL(在标准状况下)O2所需时间/s | ||||
| 酸性Fe2(SO4)3溶液 | H2O2溶液 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 4 | 0.1 | 3 | 4 | 3 | t1 |
| ② | 4 | 0.1 | 2 | 4 | V1 | 5 |
| ③ | V2 | 0.1 | V3 | 4 | 2 | t3 |
(2)实验②中0~5s内用H2O2物质的量浓度表示的反应速率为$\frac{a}{560}mol•{L}^{-1}•{s}^{-1}$.
(3)在图的方框中绘制出相应的装置.
(4)有人认为Fe3+催化H2O2分解的过程可分为两个阶段:①2Fe3++H2O2=2Fe2++O2↑+2H+,写出第二个阶段反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
| A. | K2SO4 | B. | NaHCO3 | C. | BaCl2 | D. | CuSO4 |

| A. | 制取Fe(OH)2的装置及操作 | |
| B. | 某溶液用盐酸酸化后再滴加硝酸钡溶液,检验溶液中是否含有SO42- | |
| C. | 向滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去,可证明Na2CO3溶液显碱性是由于CO32-水解造成的 | |
| D. | 将氯化铁饱和滚液与稀氨水混合,加热至沸腾,制备Fe(OH)3胶体 |
| A. | 铜铸塑像上出现铜绿[Cu2(OH)2CO3] | |
| B. | 灶具大理石板被食醋腐蚀变得不光滑 | |
| C. | 小苏打可用于治疗胃酸过多 | |
| D. | 用煤气灶燃烧天然气为炒菜提供热量 |
| A. | 若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol | |
| D. | 保持其它条件不变,如升高温度,D的体积分数增大,说明该反应的△H<0 |
①Na2CO3 ②Ca(ClO)2 ③CaCO3④CaCl2.
| A. | ①③④ | B. | ①和③ | C. | 只有② | D. | 只有④ |
| A. | 分液 | B. | 过滤 | C. | 溶解 | D. | 蒸发结晶 |