题目内容
11.在相同的条件下,一定量的氢气在氧气中充分燃烧并放出热量.若生成液态水放出的热量为Q1;若生成气态水放出的热量为Q2.那么Q1与Q2之间的关系是( )| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法确定 |
分析 物质的聚集状态不同,能量不同,物质由液体转化为气体要吸热,反之放热,以此解答该题.
解答 解:因物质由液体转化为气体吸热,则可知氢气生产液态水放出的热量多,则有Q1>Q2,
故选A.
点评 本题考查反应热的比较,为高频考点,侧重考查学生的分析能力,注意物质的聚集状态与反应热的大小关系即可解答该题,难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
1.将CO2通入下列物质的溶液中不与其反应的是( )
①Na2CO3 ②Ca(ClO)2 ③CaCO3④CaCl2.
①Na2CO3 ②Ca(ClO)2 ③CaCO3④CaCl2.
| A. | ①③④ | B. | ①和③ | C. | 只有② | D. | 只有④ |
2.实验室里由粗盐制备精盐的实验中,必需的操作步骤有( )
| A. | 分液 | B. | 过滤 | C. | 溶解 | D. | 蒸发结晶 |
19.氮原子 2p 亚层上的 3 个电子不相同的是( )
| A. | 能量 | B. | 电子云形状 | C. | 电子云伸展方向 | D. | 自旋状态 |
6.如图表示吸热反应、置换反应、氧化还原反应之间的关系,下列反应中,属于Ⅴ区域的是( )
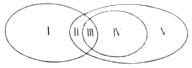

| A. | NaOH+HCl═NaCl+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
9.将2mol X和2mol Y充入2L密闭容器中发生反应:X(g)+3Y(g)?2Z(g)+a Q(g).2min达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
| A. | Y的转化率为60% | B. | 反应速率v(Y)=0.3 mol/(L•min) | ||
| C. | a的值为2 | D. | 平衡时X的浓度为0.2 mol/L |
10.某工厂排放的污水只可能含Na+、K+、NH4+、Mg2+、Fe3+、SO32-、SO42-和Cl-中的几种(忽略由水电离产生的H+、OH-).将试样平均分成甲、乙、丙各l00mL三份,每次均加入足量的试剂,设计如下实验.下列说法正确的是( )
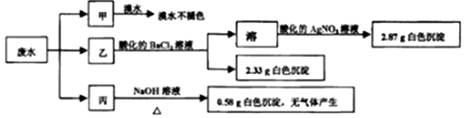

| A. | 废水可能含有Na+、K+、Fe3+ | |
| B. | 可能存在的离子用焰色反应进一步检验确认 | |
| C. | 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol•L-1 | |
| D. | 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+ |