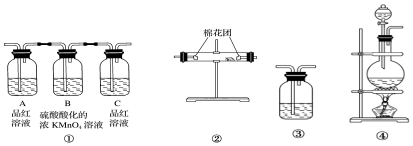
题目内容
13.取三个干燥的烧瓶,分别装入标准状况下的干燥氨气、含有二分之一体积空气的氯化氢、二氧化氮和氧气(体积比为4:1)的混合气体;然后分别做溶解于水的喷泉实验.实验结束后三个烧瓶中所得溶液的物质的量浓度之比为( )| A. | 2:1:2 | B. | 1:1:1 | C. | 5:5:4 | D. | 7:7:4 |
分析 设出烧瓶体积,根据n=$\frac{V}{Vm}$计算出烧瓶中气体的物质的量,干燥、纯净的NH3中溶液充满烧瓶,含一半空气的氯化氢气体形成的溶液体积为烧瓶容积的一半,根据c=$\frac{n}{V}$计算出溶液的浓度;根据反应4NO2+O2+2H2O=4HNO3计算出反应后溶质的物质的量,再根据c=$\frac{n}{V}$计算出硝酸的浓度,最后计算出三个烧瓶中所得溶液的物质的量浓度之比.
解答 解:设烧瓶体积为5VL,则干燥纯净的氨气体积为5VL完全溶于水后烧瓶充满溶液溶液体积也是5VL,溶质物质的量浓度为:$\frac{\frac{5VL}{22.4L/mol}}{5VL}$=$\frac{1}{22.4}$mol/L;
含一半空气的氯化氢烧瓶中氯化氢体积为2.5V完全溶解后烧瓶进水$\frac{1}{2}$,也就是溶液体积为2.5V,所以溶质物质的量浓度为:$\frac{\frac{2.5VL}{22.4L/mol}}{2.5VL}$=$\frac{1}{22.4}$mol/L;
二氧化氮与氧气体积比为4:1的混合气中NO2体积为4VL,根据以下方程式恰好完全反应:4NO2+O2+2H2O=4HNO3,而且生成硝酸物质的量为:$\frac{4VL}{22.4L/mol}$=$\frac{4V}{22.4}$mol,
由于完全反应所以烧瓶充满溶液其体积为5VL,所以溶质的物质的量浓度为:$\frac{\frac{4V}{22.4}mol}{5V}$=$\frac{1}{28}$mol/L,
所以三个烧瓶中所得溶液的溶质的物质的量浓度之比为:=$\frac{1}{22.4}$mol/L:=$\frac{1}{22.4}$mol/L:$\frac{1}{28}$mol/L=5:5:4,
故选C.
点评 本题考查物质的量浓度的计算,题目难度中等,做题时要把握二氧化氮与水反应的性质,根据物质的量浓度的计算公式进行计算.

| 选项 | 操作 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多空的海绵状碳 | 浓硫酸具有脱水性和强氧化性 |
| B | 盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液. | 溶液变成棕黄色,一段时间后,溶液中有气泡出现,随后有红褐色沉淀生成. | Fe2+催化H2O2分解产生O2; H2O2分解反应放热,促进Fe3+的水解平衡正向移动. |
| C | 将盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体,溶液变为蓝绿色 | 浓硝酸具有强氧化性 |
| D | 向等浓度的KCl、KI混合液中逐滴滴加AgNO3 溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氯水加入有色布条后,有色布条褪色,说明氯水中有 HClO 分子存在 | |
| B. | 制取漂白液的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O,该反应的氧化剂与还原剂的物质的量之比为 1:1 | |
| C. | 1mol Cl2 与足量 Fe 反应,转移的电子的物质的量为 3 mol | |
| D. | 向某铁盐溶液中滴入 KSCN 溶液,无明显现象,加入氯水,溶液显血红色,说明原溶液中含有 Fe2+ |
| A. | 芳香烃的获取主要来自煤的干馏和对石油分馏产品的催化重整 | |
| B. | 正丁烷转化为异丁烷一定有能量变化 | |
| C. | 石油的催化裂化主要目的是提高轻质液体燃料的产量尤其是汽油的产量 | |
| D. | 石油的常压分馏能得到润滑油、石蜡等 |
| A. | 25% | B. | 35% | C. | 65% | D. | 75% |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用湿润的蓝色石蕊试纸检验某气体 | 试纸变红 | 气体呈碱性 |
| B | 铁粉中加入新制氯水,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 铁粉被氧化成Fe3+ |
| C | 向Mg(OH)2的上层清液中滴加MgCl2溶液 | 沉淀变成白色 | Qc[Mg(OH)2]<Ksp[Mg(OH)2] |
| D | 将少量溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CC14,振荡静置 | 下层分别为无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CO2的电子式: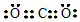 | B. | 聚丙烯的结构简式: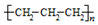 | ||
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | D. | 镁离子的结构示意图: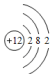 |