题目内容
18.(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.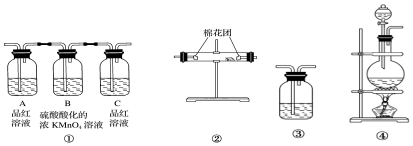
(2)试用如图所示各装置设计一个实验,验证上述反应所产生的各种产物.这些装置的连接顺序(按产物气体从左至右的流向)是④→②→①→③(填装置的编号).
(3)怎样检查整套装置的气密性关闭分液漏斗活塞,微热烧瓶,③导管口产生气泡,停止加热后③导管中有一段稳定的液柱,则气密性良好
(4)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是验证SO2的存在,
B瓶溶液的作用是充分吸收SO2,C瓶溶液的作用是验证SO2是否已被吸收完全.
(5)装置②中所加的固体药品是无水硫酸铜,可验证的产物是水.
(6)装置③中所盛溶液是澄清的石灰水,可验证的产物是CO2.
分析 碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,要验证反应产物,应依次通过盛有无水硫酸铜的硬质试管,无水硫酸铜与水反应生成五水硫酸铜,现象固体由白色变为蓝色,再通过品红溶液检验二氧化硫存在,二氧化硫具有漂白性能够使品红褪色,要检验二氧化碳应排除二氧化硫的干扰所以应先通过盛有酸性高锰酸钾的洗气瓶,再通过品红检验二氧化硫是否吸收完全,最后通入澄清石灰水,如果澄清石灰水变浑浊证明二氧化碳的存在,据此解答.
解答 解:碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,要验证反应产物,应依次通过盛有无水硫酸铜的硬质试管,无水硫酸铜与水反应生成五水硫酸铜,现象固体由白色变为蓝色,再通过品红溶液检验二氧化硫存在,二氧化硫具有漂白性能够使品红褪色,要检验二氧化碳应排除二氧化硫的干扰所以应先通过盛有酸性高锰酸钾的洗气瓶,再通过品红检验二氧化硫是否吸收完全,最后通入澄清石灰水,如果澄清石灰水变浑浊证明二氧化碳的存在.
(1)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)要验证产物,应依次通过盛有无水硫酸铜的硬质试管检验水的存在,再通过品红溶液检验二氧化硫的存在,再通过高锰酸钾溶液除去二氧化硫,再通过品红溶液检验二氧化硫是否除尽,最后通过澄清石灰水,所以正确的顺序为:④②①③;
故答案为:④②①③;
(3)装置气密性检查方法为:关闭分液漏斗活塞,微热烧瓶,③导管口产生气泡,停止加热后③导管中有一段稳定的液柱,则气密性良好;
故答案为:关闭分液漏斗活塞,微热烧瓶,③导管口产生气泡,停止加热后③导管中有一段稳定的液柱,则气密性良好;
(4)二氧化硫具有漂白性,能够使品红溶液褪色,据此检验二氧化硫的存在;要检验二氧化碳应排除二氧化硫的干扰所以应先通过盛有酸性高锰酸钾的洗气瓶,二氧化硫具有还原性,能够被高锰酸钾吸收,再通过品红检验二氧化硫是否吸收完全;
故答案为:验证SO2的存在;充分吸收SO2;验证SO2是否已被吸收完全;
(5)无水硫酸铜与水反应生成五水硫酸铜,现象固体由白色变为蓝色,据此可以判断水的存在;
故答案为:无水硫酸铜;水;
(6)二氧化碳能使澄清石灰水变浑浊,所以可以用澄清石灰水检验二氧化碳的存在;
故答案为:澄清的石灰水; CO2.
点评 本题考查了反应产物判断,明确浓硫酸的性质及反应生成二氧化硫、二氧化碳、水的性质是解题关键,注意实验设计的严密性,侧重考查学生分析实验、解决问题的能量,题目难度不大.

| A. | CH3COONa固体 | B. | Na2SO4固体 | C. | 少量NH4HSO4固体 | D. | NaOH固体 |
| A. | 此时溶液中 Fe2+和 Fe3+的物质的量之比为 3:1 | |
| B. | 向溶液中滴入 KSCN 溶液,显血红色 | |
| C. | 无法计算原混合物的质量 | |
| D. | 原混合物中 n(Fe):n(Fe2O3)=2:1 |
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 20种 |
| A. | 2:1:2 | B. | 1:1:1 | C. | 5:5:4 | D. | 7:7:4 |
| A. | 向酸性KlO3溶液中加入KI溶液:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | FeS除去污水中的微量Hg2+:FeS+Hg2+═HgS+Fe2+ | |
| C. | NaHCO3溶液呈碱性:HCO3-+H2O?CO32--+H3O+ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
| A. | 日光灯管破碎,只需收集散落的汞即可 | |
| B. | 金属镁失火,应采用泡沫灭火器灭火 | |
| C. | 钡离子中毒,可以通过服用碳酸钠溶液解毒 | |
| D. | 烧碱溶液溅到皮肤上,应立即用大量的水冲洗 |
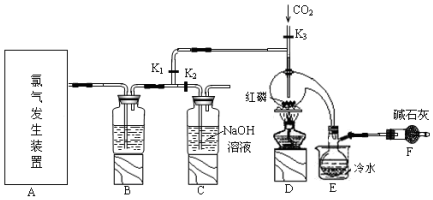
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把玻璃管口用水润湿;,然后稍稍用力即可把玻璃管插入橡皮管.
(2)B中所盛试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(3)实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷与空气中的氧气发生自燃,C装置中的K1、K2的设计也出于类似的目的,为了达到这-实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(4)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为82.5%.