题目内容
12.四种短周期主族元素在周期表中的相对位置如图所示,下列说法不正确的是( )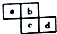
| A. | 原子半径:c>d>a>b | |
| B. | 原子序数d可能是a的3倍 | |
| C. | 最高价含氧酸的酸性c可能比d强 | |
| D. | 四种元素的氢化物可能是18电子分子 |
分析 这几种元素都是短周期主族元素,a、b位于第二周期而c、d位于第三周期,
A.原子核外电子层数越多,其原子半径越大;同一周期元素,原子半径随着原子序数增大而减小;
B.假设a的原子序数是x,则d的原子序数=x+10,如果d的原子序数是a的3倍,则3x=x+10,x=5,则a是B、d是P元素;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.如果a、b、c、d分别是N、O、S、Cl元素,其形成的18电子氢化物分别为N2H4、H2O2、H2S、HCl.
解答 解:这几种元素都是短周期主族元素,a、b位于第二周期而c、d位于第三周期,
A.原子核外电子层数越多,其原子半径越大;同一周期元素,原子半径随着原子序数增大而减小,所以这几种原子半径大小顺序是c>d>a>b,故A正确;
B.假设a的原子序数是x,则d的原子序数=x+10,如果d的原子序数是a的3倍,则3x=x+10,x=5,则a是B、d是P元素,所以原子序数d可能是a的3倍,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性c>d,所以最高价含氧酸的酸性c一定比d强,故C错误;
D.如果a、b、c、d分别是N、O、S、Cl元素,其形成的18电子氢化物分别为N2H4、H2O2、H2S、HCl,所以四种元素的氢化物可能是18电子分子,故D正确;
故选C.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析推断及发散思维能力,明确原子结构、元素周期表结构及元素周期律是解本题关键,熟记10电子、18电子微粒,题目难度不大.

练习册系列答案
相关题目
2.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式: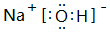 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2 b.FeCl3c.Na2SO3d.KMnO4
(5)由①和②两种元素组成的某种物质是天然气的主要成分,该物质4g完全燃烧生成CO2气体和液态水时放出222.5kJ的热量,则该物质燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol
(6)把②和⑥的条状单质用导线相连,放在由①④⑤三种元素组成的化合物的水溶液中,该装置可实现由化学能转化为电能,在该装置中单质⑥做负极,该电极反应式为Al-3e-+4 OH-=AlO2-+2H2O.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:
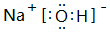 .
.(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2 b.FeCl3c.Na2SO3d.KMnO4
(5)由①和②两种元素组成的某种物质是天然气的主要成分,该物质4g完全燃烧生成CO2气体和液态水时放出222.5kJ的热量,则该物质燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol
(6)把②和⑥的条状单质用导线相连,放在由①④⑤三种元素组成的化合物的水溶液中,该装置可实现由化学能转化为电能,在该装置中单质⑥做负极,该电极反应式为Al-3e-+4 OH-=AlO2-+2H2O.
3.下列物质的类别与所含能团都正确的是( )
(1) 酚类-OH
酚类-OH
(2) 羧酸-COOH--
羧酸-COOH--
(3) 醛类
醛类
(4)CH3-O-CH3醚类
(5 酯类
酯类
(1)
 酚类-OH
酚类-OH(2)
 羧酸-COOH--
羧酸-COOH--(3)
 醛类
醛类
(4)CH3-O-CH3醚类

(5
 酯类
酯类
| A. | (1)(2)(3)(4)(5) | B. | (2)(4) | C. | (2)(3)(4) | D. | (2)(4)(5) |
7.某同学按如图所示的装置进行电解实验.下列说法正确的是( )
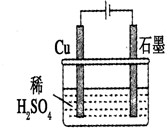

| A. | 石墨是电解池的负极,Cu是电解池的正极 | |
| B. | 电解过程中,铜电极上自身没什么变化 | |
| C. | 电解一定时间后,石墨电极上会有铜析出 | |
| D. | 整个电解过程中,溶液的pH不会变化 |
14.无机化合物可根据其组成和性质进行分类,例如:

(1)如图所示的物质分类方法名称是树状分类法.
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、⑥后面.
(3)在①③⑦⑨中属电解质的是①③(填序号).
(4)写出①与③发生中和反应离子方程式H++OH-=H2O.
(5)写出实验室制备⑨的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2.
(6)硝酸的摩尔质量是63g/mol.3.4g氨气是0.2mol;分子数是0.2NA个;含氢原子0.6mol.在标准状况下,4.48L CO2是与6.4g O2的物质的量相等.

(1)如图所示的物质分类方法名称是树状分类法.
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、⑥后面.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②HNO3 | ③NaOH ④KOH | ⑤Na2SO4 ⑥K2SO4,KNO3 | ⑦SO2 ⑧SO3 | ⑨NH3 |
(4)写出①与③发生中和反应离子方程式H++OH-=H2O.
(5)写出实验室制备⑨的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2.
(6)硝酸的摩尔质量是63g/mol.3.4g氨气是0.2mol;分子数是0.2NA个;含氢原子0.6mol.在标准状况下,4.48L CO2是与6.4g O2的物质的量相等.

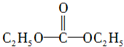 .
.

