题目内容
17.工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:2Al2O3+6Cl2$\frac{\underline{\;\;△\;\;}}{\;}$4AlCl3+3O2.(1)为促进反应的进行,实际生产中需加入焦炭,其原因是加入焦炭消耗反应生成的氧气,使平衡向正反应方向移动.
(2)加入焦炭后的化学反应可表示为Al2O3+C+Cl2$\stackrel{△}{→}$AlCl3+X↑,设计实验确定气体X的将气体通入澄清石灰水中,若澄清石灰水变浑浊,则说明生成的气体X为CO2.
(3)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物.该反应的化学方程式为Al+3FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+3FeCl2.
(4)以铝土矿为原料可以通过以下途径提纯氧化铝:

①写出滤液甲中溶质的化学式:NaOH、NaAlO2、Na2SiO3.
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
③要进一步获得金属铝,工业上采用的冶炼方法是电解法,
有关反应的化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
分析 (1)减少生成物浓度平衡正向移动;
(2)根据元素守恒知,X为二氧化碳,实验室用澄清石灰水检验二氧化碳;
(3)Al和氯化铁发生氧化还原反应生成氯化铝和氯化亚铁;
(4)铝土矿加入过量NaOH可将SiO2、Al2O3溶解,Fe2O3不反应,然后过滤,滤液甲中含有NaAlO2、NaOH、Na2SiO3,甲中加入过量稀盐酸,NaAlO2、NaOH、Na2SiO3和稀盐酸反应后生成NaCl、AlCl3、H2SiO3,过滤后的溶液中含有NaCl、AlCl3、HCl,滤液乙中加入过量氨水,生成Al(OH)3沉淀和NH4Cl,过滤将氢氧化铝灼烧得到Al2O3.
解答 解:(1)减少生成物浓度平衡正向移动,加入焦炭消耗反应生成的氧气,使平衡向着正反应方向移动,故答案为:加入焦炭消耗反应生成的氧气,使平衡向正反应方向移动;
(2)所生成的气体X为CO2,检验方法为将气体通入澄清石灰水中,若澄清石灰水变浑浊,则说明生成的气体X为CO2,
故答案为:将气体通入澄清石灰水中,若澄清石灰水变浑浊,则说明生成的气体X为CO2;
(3)加入铝粉,可将FeCl3还原为熔点较高的FeCl2.在提纯时可避免AlCl3中混有FeCl3,化学方程式为Al+3FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+3FeCl2,
故答案为:Al+3FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+3FeCl2;
(4)铝土矿加入过量NaOH可将SiO2、Al2O3溶解,Fe2O3不反应,然后过滤,滤液甲中含有NaAlO2、NaOH、Na2SiO3,甲中加入过量稀盐酸,NaAlO2、NaOH、Na2SiO3和稀盐酸反应后生成NaCl、AlCl3、H2SiO3,过滤后的溶液中含有NaCl、AlCl3、HCl,滤液乙中加入过量氨水,生成Al(OH)3沉淀和NH4Cl,过滤将氢氧化铝灼烧得到Al2O3;
①铝土矿中加入过量NaOH溶液,其中Al2O3和SiO2与NaOH反应,生成可溶的NaAlO2和Na2SiO3存在滤液甲中,还有未反应的NaOH,故答案为:NaOH、NaAlO2、Na2SiO3;
②滤液乙中加入过量氨水的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
③工业上采取电解熔融Al2O3的方法获得金属铝,化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$ 4Al+3O2↑,
故答案为:电解法;2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$ 4Al+3O2↑.
点评 本题考查物质制备,为高频考点,涉及物质制备、物质分离和提纯、金属冶炼、物质检验等知识点,明确元素化合物性质、物质分离提纯方法等知识点是解本题关键,注意:工业上用电解熔融氧化铝的方法冶炼Al,不能用电解氯化铝的方法冶炼Al,因为熔融状态下氯化铝不导电.

| A. | 该反应为可逆反应,不可能进行到底,即乙醇的转化率一定达不到100% | |
| B. | 乙酸挥发,导致其量减少,乙醇过量,不能充分转化为乙酸乙酯 | |
| C. | 产物不稳定,易被氧化为其他物质而影响乙醇的转化率 | |
| D. | 馏出物导入饱和碳酸钠溶液液面上,有较多的乙酸乙酯溶解于水溶液中 |
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.| 物质 | 沸点/°C | 密度/g?cm-3 |
| 乙醇 | 78.0 | 0.79 |
| 乙酸 | 117.9 | 1.05 |
| 乙酸乙酯 | 77.5 | 0.90 |
| 异戊醇 | 131 | 0.8123 |
| 乙酸异戊酯 | 142 | 0.8670 |
①配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
②按图连接实验装置并检验气密性
③分别在试管1、试管2中加入反应液
④用酒精灯微热3min,再加热使之微微沸腾3min
⑤分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:碎瓷片(按着加入的先后顺序写出名称),乙醇过量的目的是:提高乙酸的转化率;
(2)该反应的平衡常数表达式K=$\frac{[C{H}_{3}COOC{H}_{2}C{H}_{3}][{H}_{2}O]}{[CH{\;}_{3}COOH][C{H}_{{\;}_{3}}C{H}_{2}OH]}$;
(3)试管Ⅱ中所盛试剂为饱和碳酸钠溶液,欲将其物质分离使用的仪器为分液漏斗,在充分振荡的过程中,发生的反应为2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验A、C(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动;
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中的得到,那么产率会低(“较高”或“偏低”).
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | 不反应 | 溶解 | 生成氢气 |
| B | 不反应 | 有银镜反应 | 有红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
ACH3CH2COOH BCH3CHOHCHO或CH2OHCH2CHOCHCOOCH2CH3 DCH3COOCH3.
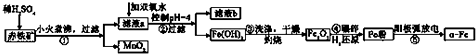
已知:部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
(2)将第①步过滤所得的MnO2与KClO3、KOH溶液共热,可得到K2MnO4和KCl,此反应的化学方程式是3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O.
(3)步骤③灼烧所需的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳.
(4)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式3Fe+2O2$\frac{\underline{\;撞击\;}}{\;}$Fe3O4.
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
C(石墨)+O2(g)═CO2 (g)△H=-393.5kJ•mol-1
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H为( )
| A. | 1 641.0 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
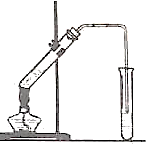 如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.