题目内容
取质量均为m g的铁铜混合物四份,分别加入同浓度,不同体积的稀硝酸充分反应,在标准状况下生成NO(设还原产物只有一种)体积与剩余固体金属的质量如表.下列判断不正确的是( )
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
| A、实验1中溶解的金属是铁且质量为4.2g |
| B、实验2中4.8g金属的组成是铁与铜 |
| C、实验4发生反应的离子方程式:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| D、实验4中V的数值为4.48 |
考点:有关混合物反应的计算
专题:计算题
分析:由表中数据可知,实验1、2都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验1的基础上加入100mL硝酸,参加反应的金属的质量为9g-4.8g=4.2g,生成NO的体积为2.24L-1.12L=1.12L,NO物质的量为0.05mol,根据电子转移守恒可知,参加反应金属的物质的量为
=0.075mol,参加反应金属的平均摩尔质量为
=56g/mol,故该过程只有Fe参加反应,则实验1只有Fe参与反应;
在实验2的基础上加入100mL硝酸,参加反应的金属的质量为4.8g,生成NO的体积为3.36L-2.24L=1.12L,NO物质的量为0.05mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量=
=0.075mol,Cu的质量=0.075mol×64g/mol=4.8g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,故加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验3的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,据此解答.
| 0.05mol×(5-2) |
| 2 |
| 4.2g |
| 0.075mol |
在实验2的基础上加入100mL硝酸,参加反应的金属的质量为4.8g,生成NO的体积为3.36L-2.24L=1.12L,NO物质的量为0.05mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量=
| 0.1mol×(5-2) |
| 2 |
解答:
解:由表中数据可知,实验1、2都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验1的基础上加入100mL硝酸,参加反应的金属的质量为9g-4.8g=4.2g,生成NO的体积为2.24L-1.12L=1.12L,NO物质的量为0.05mol,根据电子转移守恒可知,参加反应金属的物质的量为
=0.075mol,参加反应金属的平均摩尔质量为
=56g/mol,故该过程只有Fe参加反应,则实验1只有Fe参与反应;
在实验2的基础上加入100mL硝酸,参加反应的金属的质量为4.8g,生成NO的体积为3.36L-2.24L=1.12L,NO物质的量为0.05mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量=
=0.075mol,Cu的质量=0.075mol×64g/mol=4.8g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,故加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验3的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,
A.由上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为
=0.05mol,根据方程式可知,参加反应的Fe的物质的量为0.05mol×
=0.075mol,故参加反应Fe的质量=0.075mol×56g/mol=4.2g,故A正确;
B.由上述分析可知,实验2中4.8g金属为Cu,故B错误;
C.实验4发生反应为硝酸与溶液中亚铁离子反应生成NO,反应离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,故C正确;
D.Fe完全溶解生成NO为2.24L,物质的量为0.1mol,根据电子转移守恒,溶液中n(Fe2+)=
=0.15mol,由3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,可知生成NO为0.15mol×
=0.05mol,故生成NO的体积为0.05mol×22.4L/mol=1.12L,故V=3.36+1.12=4.48,故D正确;
故选B.
| 0.05mol×(5-2) |
| 2 |
| 4.2g |
| 0.075mol |
在实验2的基础上加入100mL硝酸,参加反应的金属的质量为4.8g,生成NO的体积为3.36L-2.24L=1.12L,NO物质的量为0.05mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量=
| 0.1mol×(5-2) |
| 2 |
A.由上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为
| 1.12L |
| 22.4L/mol |
| 3 |
| 2 |
B.由上述分析可知,实验2中4.8g金属为Cu,故B错误;
C.实验4发生反应为硝酸与溶液中亚铁离子反应生成NO,反应离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,故C正确;
D.Fe完全溶解生成NO为2.24L,物质的量为0.1mol,根据电子转移守恒,溶液中n(Fe2+)=
| 0.1mol×(5-2) |
| 2 |
| 1 |
| 3 |
故选B.
点评:本题考查混合物的有关计算,根据表中数据判断各阶段发生的反应是解题关键,侧重对学生综合能力的考查,本题过程复杂、计算量较大,为易错题目,难度较大.

练习册系列答案
相关题目
下列溶液中c(Cl-)与50mL 1mol?L-1 AlCl3溶液中c(Cl-)相等的是( )
| A、150 mL 1 mol?L-1的NaCl溶液 |
| B、75 mL 3 mol?L-1MgCl2溶液 |
| C、150 mL 2 mol?L-1的KCl溶液 |
| D、75 mL 1 mol?L-1的FeCl3溶液 |
下列物质中,属于碱的是( )
| A、CO2 |
| B、HCl |
| C、NaCl |
| D、KOH |
下列叙述中正确的是( )
| A、同一周期中,碱金属元素的第一电离能最大 |
| B、ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C、若X原子2p轨道上有一个空轨道,Y原子3p轨道上只有一个空轨道,则它们一定同主族 |
| D、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子则它们一定同主族 |
浓度为2mol?L-1的NaOH溶液150mL,吸收了4.48LCO2(标准状况).下列说法正确的是( )
| A、HCO3-离子数略多于CO32-离子数 |
| B、HCO3-离子数等于CO32-离子数 |
| C、HCO3-离子数略少于CO32-离子数 |
| D、Na+离子数等于HCO3-离子数和CO32-离子数之和 |
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A、加入合金的质量可能为9.6g |
| B、参加反应的硝酸的物质的量为0.4mol |
| C、沉淀完全时消耗NaOH溶液体积为150mL |
| D、溶解合金时产生NO气体体积2.24L(STP) |
有一铁粉和氧化铜的混合物6.96g,进行如下实验:
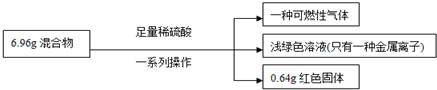
根据实验所得数据,关于混合物相关说法正确的是( )

根据实验所得数据,关于混合物相关说法正确的是( )
| A、原混合物中铁的质量分数无法计算 |
| B、实验中反应的H2SO4 用浓稀均可 |
| C、生成气体质量为0.2g |
| D、原混合物中铜元素的质量不一定为0.64g |
将29.5g乙烯和乙烷的混合气体通入足量的溴水后,溴水增重7g,则混合气体中乙烯的体积分数是( )
| A、75% | B、50% |
| C、30% | D、25% |