题目内容
下列叙述中正确的是( )
| A、同一周期中,碱金属元素的第一电离能最大 |
| B、ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C、若X原子2p轨道上有一个空轨道,Y原子3p轨道上只有一个空轨道,则它们一定同主族 |
| D、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子则它们一定同主族 |
考点:元素电离能、电负性的含义及应用,元素周期表的结构及其应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.越容易失电子的元素其第一电离能越小;
B.第VIA族元素的原子,原子半径越大,该元素越不容易得电子;
C.若X原子2p轨道上有一个空轨道,X元素为C元素,Y原子3p轨道上只有一个空轨道,Y为Si元素;
D.原子核外M层上仅有两个电子的X原子,X为Mg元素,原子核外N层上仅有两个电子的Y原子,Y可能是Ca、Sc、Ti、V、Mn、Fe、Co、Ni或Zn元素.
B.第VIA族元素的原子,原子半径越大,该元素越不容易得电子;
C.若X原子2p轨道上有一个空轨道,X元素为C元素,Y原子3p轨道上只有一个空轨道,Y为Si元素;
D.原子核外M层上仅有两个电子的X原子,X为Mg元素,原子核外N层上仅有两个电子的Y原子,Y可能是Ca、Sc、Ti、V、Mn、Fe、Co、Ni或Zn元素.
解答:
解:A.越容易失电子的元素其第一电离能越小,同一周期中,碱金属元素最容易失电子,则金属元素第一电离能最小,故A错误;
B.第VIA族元素的原子,原子半径越大,该元素的原子核对最外层电子吸引力越小,则该元素越不容易得电子,故B错误;
C.若X原子2p轨道上有一个空轨道,X元素为C元素,Y原子3p轨道上只有一个空轨道,Y为Si元素,二者都属于第VIA族元素,所以它们一定为同一主族,故C正确;
D.原子核外M层上仅有两个电子的X原子,X为Mg元素,原子核外N层上仅有两个电子的Y原子,Y可能是Ca、Sc、Ti、V、Mn、Fe、Co、Ni或Zn元素,只有Mg和Ca属于同一主族,Mg和Sc、Ti、V、Mn、Fe、Co、Ni和Zn都不属于同一族,故D错误;
故选C.
B.第VIA族元素的原子,原子半径越大,该元素的原子核对最外层电子吸引力越小,则该元素越不容易得电子,故B错误;
C.若X原子2p轨道上有一个空轨道,X元素为C元素,Y原子3p轨道上只有一个空轨道,Y为Si元素,二者都属于第VIA族元素,所以它们一定为同一主族,故C正确;
D.原子核外M层上仅有两个电子的X原子,X为Mg元素,原子核外N层上仅有两个电子的Y原子,Y可能是Ca、Sc、Ti、V、Mn、Fe、Co、Ni或Zn元素,只有Mg和Ca属于同一主族,Mg和Sc、Ti、V、Mn、Fe、Co、Ni和Zn都不属于同一族,故D错误;
故选C.
点评:本题考查原子结构、元素周期律、电离能等知识点,侧重考查学生对周期表结构、原子结构的掌握及灵活运用元素周期律知识能力,易错选项是D,熟练掌握前36号元素原子结构.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,48gO3含有氧原子数为NA |
| B、标准状况下,1.8g的H2O中含有的电子数为NA |
| C、常温常压下,11.2L氧气所含的原子数为NA |
| D、2.8g铁与足量盐酸反应失去的电子数为0.15NA |
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
| A、能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 | ||||
B、惰性电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| C、NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O=2HClO+CO32- | ||||
| D、向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |
下列属于物理变化的是( )
| A、煤的干馏 | B、石油的裂解 |
| C、煤的气化 | D、石油的分馏 |
下列各组物质中,只要总质量一定,不论以何种比例混合,完全燃烧,生成的二氧化碳和水的质量也总是定值的是( )
| A、丙烷和丙烯 |
| B、乙酸和葡萄糖 |
| C、乙炔和丁烯 |
| D、乙醇和乙醚 |
取质量均为m g的铁铜混合物四份,分别加入同浓度,不同体积的稀硝酸充分反应,在标准状况下生成NO(设还原产物只有一种)体积与剩余固体金属的质量如表.下列判断不正确的是( )
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
| A、实验1中溶解的金属是铁且质量为4.2g |
| B、实验2中4.8g金属的组成是铁与铜 |
| C、实验4发生反应的离子方程式:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| D、实验4中V的数值为4.48 |
下列各组物质总物质的量一定,两种物质以任何比例相混合并充分燃烧,生成H2O和CO2的物质的量之比始终不变的是( )
①甲醇和乙醛 ②乙烷和乙烯 ③乙炔和苯 ④乙酸和葡萄糖
⑤乙醇和甲醚 ⑥丙醛和甲醚 ⑦苯酚和苯二酚.
①甲醇和乙醛 ②乙烷和乙烯 ③乙炔和苯 ④乙酸和葡萄糖
⑤乙醇和甲醚 ⑥丙醛和甲醚 ⑦苯酚和苯二酚.
| A、③④⑤⑦ | B、③④⑥⑦ |
| C、①②⑤⑥ | D、①③⑤⑥ |
有两种金属粉未的混合物26g,投入足量的稀硫酸中充分反应,产生11.2L标准状况时的氢气,此混合物可能是( )
| A、Fe和Zn |
| B、Al和Zn |
| C、Mg和Al |
| D、Fe和Cu |
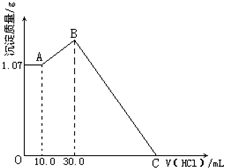 将FeCl3、AlCl3两种固体混合物溶于足量水后加入一定量的NaOH溶液,产生1.07g红褐色沉淀,再向所得浊液中逐滴滴加1.00mol?L-1HCl溶液,加入HCl溶液的体积与生产沉淀的关系如图所示,试回答:
将FeCl3、AlCl3两种固体混合物溶于足量水后加入一定量的NaOH溶液,产生1.07g红褐色沉淀,再向所得浊液中逐滴滴加1.00mol?L-1HCl溶液,加入HCl溶液的体积与生产沉淀的关系如图所示,试回答: