题目内容
有一铁粉和氧化铜的混合物6.96g,进行如下实验:
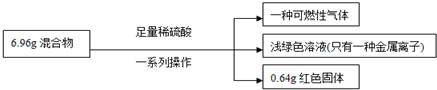
根据实验所得数据,关于混合物相关说法正确的是( )

根据实验所得数据,关于混合物相关说法正确的是( )
| A、原混合物中铁的质量分数无法计算 |
| B、实验中反应的H2SO4 用浓稀均可 |
| C、生成气体质量为0.2g |
| D、原混合物中铜元素的质量不一定为0.64g |
考点:有关混合物反应的计算
专题:计算题
分析:生成可燃性气体,说明铁粉过量,发生反应:Fe+H2SO4=FeSO4+H2↑,反应后的溶液为浅绿色,且只有一种金属离子,则发生反应CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换;根据Cu的质量计算CuO质量,进而计算Fe的质量,根据电子转移计算生成氢气的质量.
解答:
解:生成可燃性气体,说明发生反应:Fe+H2SO4=FeSO4+H2↑,溶液为浅绿色,只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,
生成0.64gCu,其物质的量:
=0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
故混合物中m(CuO)=0.01mol×80g/mol=0.8g,则:m(Fe)=6.96g-0.8g=6.16g,n(Fe)=
=0.11mol,
A.由上述分析可知,Fe的质量为6.16g,可以计算混合物中Fe的质量分数,故A错误;
B.浓硫酸与铁发生钝化,无法将铁完全溶解,所以不能使用浓硫酸,故B错误;
C.设氢气的物质的量为nmol,根据电子转移守恒,由2n+0.01mol×2=0.11mol×2,解得n=0.1mol,故氢气的质量:0.1mol×2g/mol=0.2g,故C正确;
D.由上述分析可知,原混合物中铜元素的质量为0.64g,故D错误;
故选C.
生成0.64gCu,其物质的量:
| 0.64g |
| 64g/mol |
故混合物中m(CuO)=0.01mol×80g/mol=0.8g,则:m(Fe)=6.96g-0.8g=6.16g,n(Fe)=
| 6.16g |
| 56g/mol |
A.由上述分析可知,Fe的质量为6.16g,可以计算混合物中Fe的质量分数,故A错误;
B.浓硫酸与铁发生钝化,无法将铁完全溶解,所以不能使用浓硫酸,故B错误;
C.设氢气的物质的量为nmol,根据电子转移守恒,由2n+0.01mol×2=0.11mol×2,解得n=0.1mol,故氢气的质量:0.1mol×2g/mol=0.2g,故C正确;
D.由上述分析可知,原混合物中铜元素的质量为0.64g,故D错误;
故选C.
点评:本题考查混合物计算,题目难度中等,根据题中信息确定反应原理为解答本题关键,注意根据守恒思想计算可简化计算步骤,也可根据反应的方程式进行计算.

练习册系列答案
相关题目
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
| A、能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 | ||||
B、惰性电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| C、NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O=2HClO+CO32- | ||||
| D、向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |
取质量均为m g的铁铜混合物四份,分别加入同浓度,不同体积的稀硝酸充分反应,在标准状况下生成NO(设还原产物只有一种)体积与剩余固体金属的质量如表.下列判断不正确的是( )
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
| A、实验1中溶解的金属是铁且质量为4.2g |
| B、实验2中4.8g金属的组成是铁与铜 |
| C、实验4发生反应的离子方程式:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| D、实验4中V的数值为4.48 |
下列各组物质总物质的量一定,两种物质以任何比例相混合并充分燃烧,生成H2O和CO2的物质的量之比始终不变的是( )
①甲醇和乙醛 ②乙烷和乙烯 ③乙炔和苯 ④乙酸和葡萄糖
⑤乙醇和甲醚 ⑥丙醛和甲醚 ⑦苯酚和苯二酚.
①甲醇和乙醛 ②乙烷和乙烯 ③乙炔和苯 ④乙酸和葡萄糖
⑤乙醇和甲醚 ⑥丙醛和甲醚 ⑦苯酚和苯二酚.
| A、③④⑤⑦ | B、③④⑥⑦ |
| C、①②⑤⑥ | D、①③⑤⑥ |
CO和CO2混合气体含碳元素36%,取此混合气体10g,通过足量灼热的CuO后,将气体通过足量的澄清石灰水,得到白色沉淀的质量是( )
| A、5g | B、10g |
| C、20g | D、30g |
在密闭容器中,对于反应:N2(g)+3H2(g)?2NH3(g),在反应起始时N2和H2分别为10mol和30mol,当达到平衡时,N2的转化率为30%.若以NH3为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则NH3的起始物质的量和它的转化率,正确的是( )
| A、20mol;70% |
| B、20mol;30% |
| C、40mol;35% |
| D、10mol;50% |
有两种金属粉未的混合物26g,投入足量的稀硫酸中充分反应,产生11.2L标准状况时的氢气,此混合物可能是( )
| A、Fe和Zn |
| B、Al和Zn |
| C、Mg和Al |
| D、Fe和Cu |