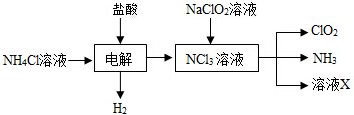
题目内容
11.火箭推进器常以联氨(N2H4) 为燃料、过氧化氢为助燃剂.已知下列各物质反应的热化学方程式:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H1=-533.23kJ•mol-1H2O(g)═H2O (l)△H2=-44kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H3=-196.4kJ•mol-1
则联氨与过氧化氢反应的热化学方程式可表示为( )
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-817.63 kJ•mol-1 |
分析 根据盖斯定律①+②×2+③可得N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)、①-②×2+③:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g),注意产物中水的状态不同,放出的热量不同.
解答 解:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H1=-533.23kJ•mol-1 ①
H2O(g)=H2O (l)△H2=-44kJ•mol-1 ②
2H2O2(l)=2H2O(l)+O2(g)△H3=-196.4kJ•mol-1 ③
根据盖斯定律①+②×2+③可得:N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.63kJ•mol-1
或用①-②×2+③:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ•mol-1,
故选B.
点评 本题考查了热化学方程式的书写与盖斯定律的应用,题目难度不大,明确盖斯定律的原理和热化学方程式的书写规则为解题的关键,试题培养了学生的灵活应用能力

练习册系列答案
相关题目
2.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | YZ2溶于水形成的溶液具有较强的氧化性 | |
| C. | 1molWM溶于足量水中完全反应共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
3.分子式为C7H8O2并能与金属钠反应的芳香化合物有( )
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
20.常温下,纯水中存在电离平衡:H2O?H++OH-,若要使水的电离平衡向电离方向移动,并使c(H+)增大,可加入的适当物质是( )
| A. | 硫酸氢钠 | B. | 明矾 | C. | 碳酸氢钠 | D. | 醋酸钠 |
17.将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合后,溶液中下列微粒的物质的量浓度的关系正确的是( )
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |