题目内容
20.常温下,纯水中存在电离平衡:H2O?H++OH-,若要使水的电离平衡向电离方向移动,并使c(H+)增大,可加入的适当物质是( )| A. | 硫酸氢钠 | B. | 明矾 | C. | 碳酸氢钠 | D. | 醋酸钠 |
分析 酸、碱或强酸酸式盐能抑制水电离,含有弱离子的盐促进水电离;欲使水的电离平衡向正方向移动,并使c(H+)增大,可加入能水解生成酸性的盐,以此解答该题.
解答 解:A.硫酸氢钠完全电离生成氢离子而导致溶液中c(H+),从而抑制水电离,故A错误;
B.明矾在溶液中电离出铝离子,铝离子结合水电离的氢氧根离子,促进了水的电离,氢离子浓度增大,故B正确;
C.碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度而促进水电离,但溶液中c(OH-)增大、c(H+)减小,故C错误;
D.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,促进水电离,但溶液中溶液中c(OH-)增大、c(H+)减小,故D错误;
故选B.
点评 本题以盐类水解为载体考查水的电离,题目难度中等,明确影响水电离因素是解本题关键,知道常见盐的类型及其溶液酸碱性,易错选项是A,注意硫酸氢钠溶液相当于强酸溶液.

练习册系列答案
相关题目
10.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系正确的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊,继续通入CO2至过量,溶液变澄清 | BaCl2溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色退去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,无明显变化 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
11.火箭推进器常以联氨(N2H4) 为燃料、过氧化氢为助燃剂.已知下列各物质反应的热化学方程式:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H1=-533.23kJ•mol-1
H2O(g)═H2O (l)△H2=-44kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H3=-196.4kJ•mol-1
则联氨与过氧化氢反应的热化学方程式可表示为( )
H2O(g)═H2O (l)△H2=-44kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H3=-196.4kJ•mol-1
则联氨与过氧化氢反应的热化学方程式可表示为( )
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-817.63 kJ•mol-1 |
8.如图所示装置是一种可充电电池示意图,装置中的离子交换膜只允许Na+通过.已知充放电的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.下列说法正确的是( )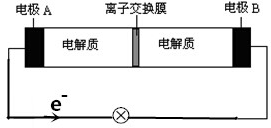

| A. | 放电时,Na+从右到左通过离子交换膜 | |
| B. | 放电时,负极反应式为3NaBr-2e-═NaBr3+2Na+ | |
| C. | 充电时,A极应与直流电源负极相连 | |
| D. | 放电时,当有0.1molNa+通过离子交换膜时,B极上有0.3molNaBr产生 |
15.下列说法中,正确的是( )
| A. | 甲醛、乙醛、丙醛通常情况下都是液体 | |
| B. | 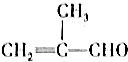 是乙醛的同系物 是乙醛的同系物 | |
| C. | 可用浓盐酸洗去银镜反应实验生成的银镜 | |
| D. | 1mol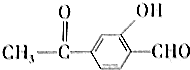 最多能与5mol H2发生反应 最多能与5mol H2发生反应 |
1.在一定温度下,有以下反应:2A(g)+B(g)?C(g)+D(g)△H<0,反应进行至第10min 时,改变一个条件,当反应进行至第20min 时,发现生成C的速率增大,C的百分含量也增大,则改变的条件可能是( )
| A. | 加热 | B. | 使用催化剂 | C. | 加压 | D. | 分离出D |
8.下列说法正确的是( )
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝能与冷水反应 | |
| C. | 铝热反应常用于冶炼某些熔点较高的金属 | |
| D. | 冶炼铝可用电解AlCl3的方法 |