题目内容
1.据报道,某地化工厂的贮氯罐意外发生泄漏,为了厂区和周围地区群众的安全,有关方面紧急组织群众沿逆风方向疏散;同时,迅速赶到的消防队员向贮氯罐周围的空中喷洒稀NaOH溶液.(1)为什么要沿逆风方向疏散群众?
(2)喷洒稀NaOH溶液的目的是什么?写出有关的化学方程式.
分析 氯气有毒,可与氢氧化钠溶液反应,以此解答该题.
解答 解:(1)氯气是一种有毒的气体,氯气会顺着风向逸散,所以疏散时应该逆着风向转移,防止中毒,
答:氯气顺着风向逸散,沿逆风方向疏散群众,防止中毒;
(2)氯气与氢氧化钠溶液反应,可用氢氧化钠溶液吸收,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
答:氢氧化钠溶液吸收氯气,Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查氯气的性质,为高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识积累,难度不大.

练习册系列答案
相关题目
7.在含有H+、Cl-、Na+的溶液中,还可以大量共存的离子是( )
| A. | CO32- | B. | AlO2- | C. | Ca2+ | D. | Ag+ |
12.某无色溶液中,加入铝可以生成H2,则在该溶液中一定能大量存在的离子组是( )
| A. | K+、Cu2+、NO3-、Cl- | B. | K+、Na+、Br-、Cl- | ||
| C. | K+、NH4+、HCO3-、Cl- | D. | Na+、Mg2+、Br-、SO42- |
9.下列与NH4Fe(SO4)2•24H2O溶液有关描述及离子方程式正确的是( )
| A. | 该溶液中H+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 该溶液中滴入少量NaOH溶液:3NH4++Fe3++6OH-=3NH3↑+Fe(OH)3↓ | |
| C. | 该溶液中加入足量的Zn粉:2Fe3++Zn=Zn2++2Fe2+ | |
| D. | 先加盐酸再加入BaCl2溶液:SO42-+Ba2+=BaSO4↓ |
16.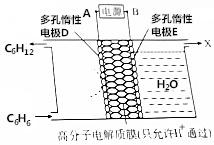 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )| A. | A极为电源的正极 | |
| B. | 储氢反应的电极反应式为:C6H6+6H++6e-═C6H12 | |
| C. | 右室得到的气体X为O2 | |
| D. | 该储氢和储能的反应为2C6H6+6H2O$\frac{\underline{\;通电\;}}{\;}$2C6H12+3O2↑ |
6.下列叙述正确的是( )
| A. | 常温下pH=7的溶液中:Fe3 +、Mg2 +、SO4 2-、Cl- 能大量共存 | |
| B. | 25℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大 | |
| C. | 浓度均为0.1 mol•L- 1 的下列溶液,pH由大到小的排列顺序为:NaOH>Na2 CO3>(NH4 )2 SO4>NaHSO4 | |
| D. | 常温下水电离出c(H+ )×c(OH- )=10-20 的溶液中:Na+、ClO-、SO42 -、NH4 + 可能大量共存 |
13.一定温度下,在恒容密闭容器中发生可逆反应N2+3H2?2NH3,已知某时刻存在N2、H2、NH3的浓度为1mol•L-1、2mol•L-1、2mol•L-1,当达到平衡状态可能存在的数据是( )
| A. | N2为$\frac{1}{3}$mol•L-1 | B. | NH3为$\frac{10}{3}$mol•L-1 | ||
| C. | H2为5.5mol•L-1 | D. | N2为1.5mol•L-1,H2为3.5mol•L-1 |
10.下列说法正确的是( )
| A. | 可用细铁丝代替铂丝做焰色反应实验 | |
| B. | 容量瓶使用前须烘干 | |
| C. | 可用CCl4将溴水中的溴单质分离除净 | |
| D. | 用元素分析仪确定物质中含有哪些金属元素 |
11.在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率,可采取的措施是( )
| A. | 加催化剂 | B. | 扩大容器体积 | C. | 升高温度 | D. | 增大压强 |