题目内容
13.一定温度下,在恒容密闭容器中发生可逆反应N2+3H2?2NH3,已知某时刻存在N2、H2、NH3的浓度为1mol•L-1、2mol•L-1、2mol•L-1,当达到平衡状态可能存在的数据是( )| A. | N2为$\frac{1}{3}$mol•L-1 | B. | NH3为$\frac{10}{3}$mol•L-1 | ||
| C. | H2为5.5mol•L-1 | D. | N2为1.5mol•L-1,H2为3.5mol•L-1 |
分析 结合化学平衡三行计算劣势,通过极值转化正向进行和逆向进行得到大大平衡状态下个物质的最大值和最小值,据此分析选项判断.
解答 解:一定温度下,在恒容密闭容器中发生可逆反应N2+3H2?2NH3,已知某时刻存在N2、H2、NH3的浓度为1mol•L-1、2mol•L-1、2mol•L-1,
N2+3H2?2NH3,
某时刻量(mol/L) 1 2 2
正向极值转化量(mol/L) $\frac{1}{3}$ 0 2+$\frac{4}{3}$=$\frac{10}{3}$
逆向极值转化量(mol/L) 2 5 0
达到平衡状态物质浓度为:$\frac{1}{3}$<c(N2)<2,0<c(H2)<5,0<c(NH3)<$\frac{10}{3}$,ABC不符合,D正确,
故选D.
点评 本题考查了好像平衡的极值转化关系的分析、物质浓度的取值范围的计算,掌握基础是解题关键,题目难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
3.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②天然气和水煤气都是可再生能源;③冰和干冰均既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋均既是化合物又是酸;⑥纯碱和熟石灰都是碱.上述说法正确的是( )
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥ | D. | ①③④ |
8.pC类似pH,是指稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol•L-1,则该溶液中溶质的pC=3.下列叙述正确的是( )
| A. | 常温下,0.01mol•L-1的醋酸溶液中,pC(H+)=2 | |
| B. | 常温下,向0.01mol•L-1的氨水中加入等体积等浓度的盐酸,混合液的pC(H+)<7 | |
| C. | 100℃时,0.01mol•L-1的NaOH溶液中,pC(OH-)+pC(H+)=14 | |
| D. | 100℃时,CaCO3的Ksp=2.5×10-9,其饱和溶液中pC(Ca2+)+pC(CO32-)=9 |
5.在一定温度下,相一个容积固定的密闭容器中充入2molSO2和1molO2,发生反应2SO2(g)+O2(g)?2SO3(g),反应达到平衡时,测得SO3的浓度为c mol•L-1,若起始时按下列比例配料,则平衡时SO3仍为cmol•L-1的是( )
| A. | 1molSO2、0.5molO2、1molSO3 | B. | 4molSO2、2molO2 | ||
| C. | 4molSO3 | D. | 1molSO2、1molO2、1molSO3 |
2.实验是化学研究的基础,如图装置或操作正确的是( )
| A. | 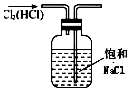 用图所示装置可得到纯净的Cl2 | |
| B. | 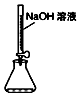 用图量取15.00mL的NaOH溶液 | |
| C. | 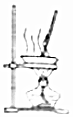 用图所示装置蒸发FeCl3溶液制备无水FeCl2 | |
| D. |  关闭分液漏斗的活塞,从b处加水,以检查装置的气密性 |
3.下列说法正确的是( )
| A. | 常温常压下,16g O3所含的氧原子数目为NA | |
| B. | 标准状况下,O2的体积取决于O2分子间的距离 | |
| C. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| D. | 若气体摩尔体积为22.4 L/mol,则所处条件为标准状况 |