题目内容
6.下列叙述正确的是( )| A. | 常温下pH=7的溶液中:Fe3 +、Mg2 +、SO4 2-、Cl- 能大量共存 | |
| B. | 25℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大 | |
| C. | 浓度均为0.1 mol•L- 1 的下列溶液,pH由大到小的排列顺序为:NaOH>Na2 CO3>(NH4 )2 SO4>NaHSO4 | |
| D. | 常温下水电离出c(H+ )×c(OH- )=10-20 的溶液中:Na+、ClO-、SO42 -、NH4 + 可能大量共存 |
分析 A.铁离子只能存在于酸性溶液中;
B.氯离子浓度增大,氯化银的溶解度会减小;
C.酸性、中性和碱性溶液的pH大小为:碱性>中性>酸性,结合盐的水解程度较小判断;
D.该溶液呈酸性或碱性,次氯酸根离子与氢离子反应,铵根离子与氢氧根离子反应.
解答 解:A.Fe3+只能存在于酸性溶液,在pH=7的溶液中不可能大量存在,故A错误;
B.向AgCl沉淀的溶解平衡体系中加入NaCl固体,溶液中氯离子浓度增大,抑制了氯化银的溶解平衡,则AgCl的溶解度减小,故B错误;
C.NaOH为强碱,碳酸钠为强碱弱酸盐,二者呈碱性,pH>7,硫酸铵为强酸弱碱盐,硫酸氢钠呈强酸性,二者的pH<7,盐的水解程度减小,则浓度相同时pH由大到小的排列顺序为:NaOH>Na2 CO3>(NH4)2SO4>NaHSO4,故C正确;
D.常温下水电离出c(H+ )×c(OH- )=10-20>10-14,说明促进了水的电离,溶液呈酸性或碱性,ClO-与氢离子反应,NH4+与氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选C.
点评 本题考查较为综合,涉及难溶物溶解平衡、溶液酸碱性与溶液pH的关系、离子共存等知识,题目难度中等,明确离子共存的条件为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.可测出某84消毒液的pH为10.2是( )
| A. | pH试纸 | B. | 红色石蕊试纸 | ||
| C. | 数字pH计 | D. | 以酚酞为指示剂进行酸碱中和滴定 |
17.下列关于有机物的说法正确的是( )
| A. | 乙烯生成乙烷、乙醇生成乙醛均属于加成反应 | |
| B. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| C. | 蚕丝和人造纤维均为高分子化合物,用灼烧的方法可区别 | |
| D. | 葡萄糖和果糖的分子式均为C6H12O6,二者互为同系物 |
14.若金属钠引起火灾,则下列物质或方法中可用于灭火的是( )
| A. | 水 | B. | 湿布 | C. | 干砂 | D. | 泡沫灭火器 |
11.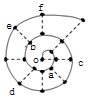 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 最高价氧化物对应的水化物的碱性:c<a | |
| B. | 简单离子半径:c>e>b | |
| C. | 简单离子影响水的电离能力:e>a>f | |
| D. | 单质的熔点:c>d>e |
15.二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备.某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图:
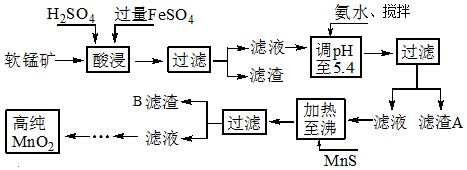
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.3,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是CuS、ZnS.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-═MnOOH+OH-.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为Mn2+-2e-+2H2O═MnO2+4H+
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为94.6%.

| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能充分氧化过量的Fe2+;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到5.3,恰好能使Fe3+、Al3+沉淀完全.
(3)滤渣B的成分是CuS、ZnS.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-═MnOOH+OH-.
(5)MnO2也可在MnSO4•H2SO4•H2O为体系的电解液中电解获得,其阳极电极反应式为Mn2+-2e-+2H2O═MnO2+4H+
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.4600g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液.取其中20.00mL,恰好与25.00mL 0.0800mol•L-1 Na2S2O3溶液反应(I2+2S2O32-═2I-+S4O62-).计算可得该样品纯度为94.6%.
16.已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol
下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol
下列结论正确的是( )
| A. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6KJ/mol | |
| B. | H2的燃烧热为241.8 KJ/mol | |
| C. | 浓硫酸与氢氧化钠溶液反应生成1molH2O(I),放出热量也等于57.3KJ | |
| D. | 稀CH3COOH溶液与稀NaOH溶液反应生成1molH2O(l),放出热量小于57.3KJ |