题目内容
20.在不同温度下.向200mL密闭容器中加入1mo1A和1molB.发生反应:2A(g)+2B(s)?C(g)+2D(g)△H<0.达到平衡时的数据如下表,下列说法不正确的是( )| 温度/℃ | N(B)/mol | N(D)/mol |
| T1 | 0.60 | - |
| T2 | - | 0.35 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{4}{9}$ | |
| C. | T2℃时,若反应达到平衡后再缩小容器的体积,c(C):c(D)不变 | |
| D. | T1℃时,若开始时反应物的用量均减小一半,平衡后A的转化率α(A)减小 |
分析 A.温度T1时,平衡时消耗的n(B)=1mol-0.6mol=0.4mol,则平衡时生成的n(D)=0.4mol,温度T2时,生成的n(CO2)=0.35mol<0.4mol,正反应为放热反应,升温平衡逆向移动,故温度T1<T2;
B.温度T1,平衡时n(A)=n(B)=0.6mol,平衡时消耗的n(B)=1mol-0.6mol=0.4mol,则平衡时生成的n(D)=0.4mol,n(C)=0.2mol,体积为200mL即0.2L,根据c=$\frac{n}{V}$计算出各物质的平衡浓度,代入平衡常数K=$\frac{c(C)×{c}^{2}(D)}{{c}^{2}(A)}$计算;
C.平衡后再缩小容器的体积,压强增大,反应向气体体积缩小的方向即逆向移动,但c(C):c(D)等于化学计量数之比,始终不变为1:2;
D.T1℃时,若开始时反应物的用量均减小一半,等效为降低压强,反应向气体体积增大的方向即正向移动,平衡后A的转化率α(A)增大.
解答 解:A.温度T1时,消平衡时耗的n(活性炭)=1mol-0.7mol=0.3mol,则平衡时生成的n(CO2)=0.3mol,温度T2时,生成的n(CO2)=0.25mol<0.3mol,平衡逆向移动,正反应为放热反应,升温平衡逆向移动,故温度T1<T2,故A正确;
B.温度T1,平衡时n(A)=n(B)=0.6mol,平衡时消耗的n(B)=1mol-0.6mol=0.4mol,则平衡时生成的n(D)=0.4mol,n(C)=0.2mol,体积为200mL即0.2L,根据c=$\frac{n}{V}$计算出各物质的平衡浓度,c(A)=c(B)=$\frac{0.6mol}{0.2L}$=3mol/L,c(C)=$\frac{0.2mol}{0.2L}$=1mol/L,c(D)=$\frac{0.4mol}{0.2L}$=2mol/L,代入平衡常数K=$\frac{c(C)×{c}^{2}(D)}{{c}^{2}(A)}$=$\frac{1×{2}^{2}}{{3}^{2}}$=$\frac{4}{9}$,故B正确;
C.平衡后再缩小容器的体积,压强增大,反应向气体体积缩小的方向即逆向移动,但c(C):c(D)等于化学计量数之比,始终不变为1:2,故C正确;
D.T1℃时,若开始时反应物的用量均减小一半,等效为降低压强,反应向气体体积增大的方向即正向移动,平衡后A的转化率α(A)增大,故D错误.
故选D.
点评 本题考查化学平衡计算与影响因素、化学平衡常数的计算,难度中等,注意反应前后气体体积,B为固体.

Ⅰ.甲同学设计并实施了如下实验方案.
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①④溶液 | 略 |
| 2 | 向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学方程式: C6H5OH+NaOH→C6H5ONa+H2O |
| 3 | 配制等物质的量浓度的CH3COONa、NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于CH3COONa溶液 | 略 |
| 4 | 将CO2通入C6H5ONa溶液中 | 产生白色浑浊 | 反应的化学方程式:C6H5ONa+CO2+H2O=C6H5OH+NaHCO3 |
| 结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)④①③② | |||
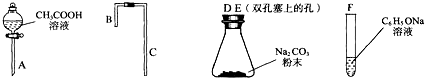
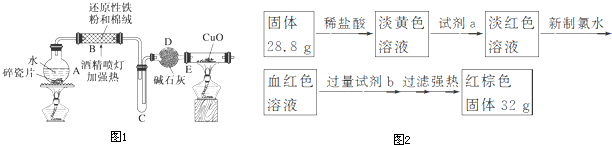
(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)D(或E)中,B管插入E(或D)中,C管插入F中.
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有饱和NaHCO3溶液的洗气装置,使乙同学的实验设计更加完善.
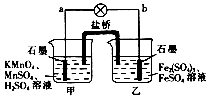
| A. | b电极上发生还原反应 | |
| B. | 甲烧杯中溶液的pH逐渐减小 | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | 外电路的电流方向是从a到b |
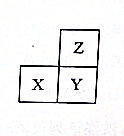
| A. | 最高正化合价:Z>X | |
| B. | X、Y、Z的单质中,Z的熔点最高 | |
| C. | 若X为非金属元素,则离子半径:Xn->Ym->Zm- | |
| D. | X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强 |
①如果加入蒸馏水,就加入900 mL
②如果加入pH=10的NaOH溶液,应加入1000 mL
③如果加入0.008mol/L HCl溶液,应加入100 mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式CO32-+H2O?HCO3-+OH-,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式Al3++3H2O?Al(OH)3+3H+,为了防止Al2(SO4)3发生水解,可加入少量的硫酸.
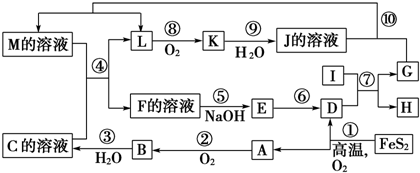
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+).
| 金属离子 | PH值 | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
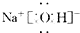
 .
.